Актуальность и цели. Стеатоз печени — распространенное явление у ВИЧ-инфицированных пациентов. Однако относительное действие ВИЧ, как и вируса гепатита C (HCV) у пациентов со смешанной инфекцией, а также влияние стеатоза на прогрессирование фиброза печени неясны.
Методы. LIVEHIV — канадское проспективное когортное исследование, использующее ультразвуковую эластографию и контролируемый параметр затухания (КПЗ) для скрининга стеатоза и фиброза печени у ВИЧ-инфицированных взрослых. Прогрессирование стеатоза было определено как развитие стеатоза любой степени (КПЗ ≥ 248 дБ/м) или переход к тяжелому стеатозу (КПЗ > 292 дБ/м) у лиц, имеющих исходно любую степень стеатоза.
Прогрессирование фиброза определялось как развитие значительного фиброза печени (показатель плотности печени [LSM] > 7,1 кПа) или переход к циррозу (LSM > 12,5 кПа) для лиц, имеющих исходно значительный фиброз печени. Для оценки предикторов стеатоза и прогрессирования фиброза использовался регрессионный анализ Кокса.
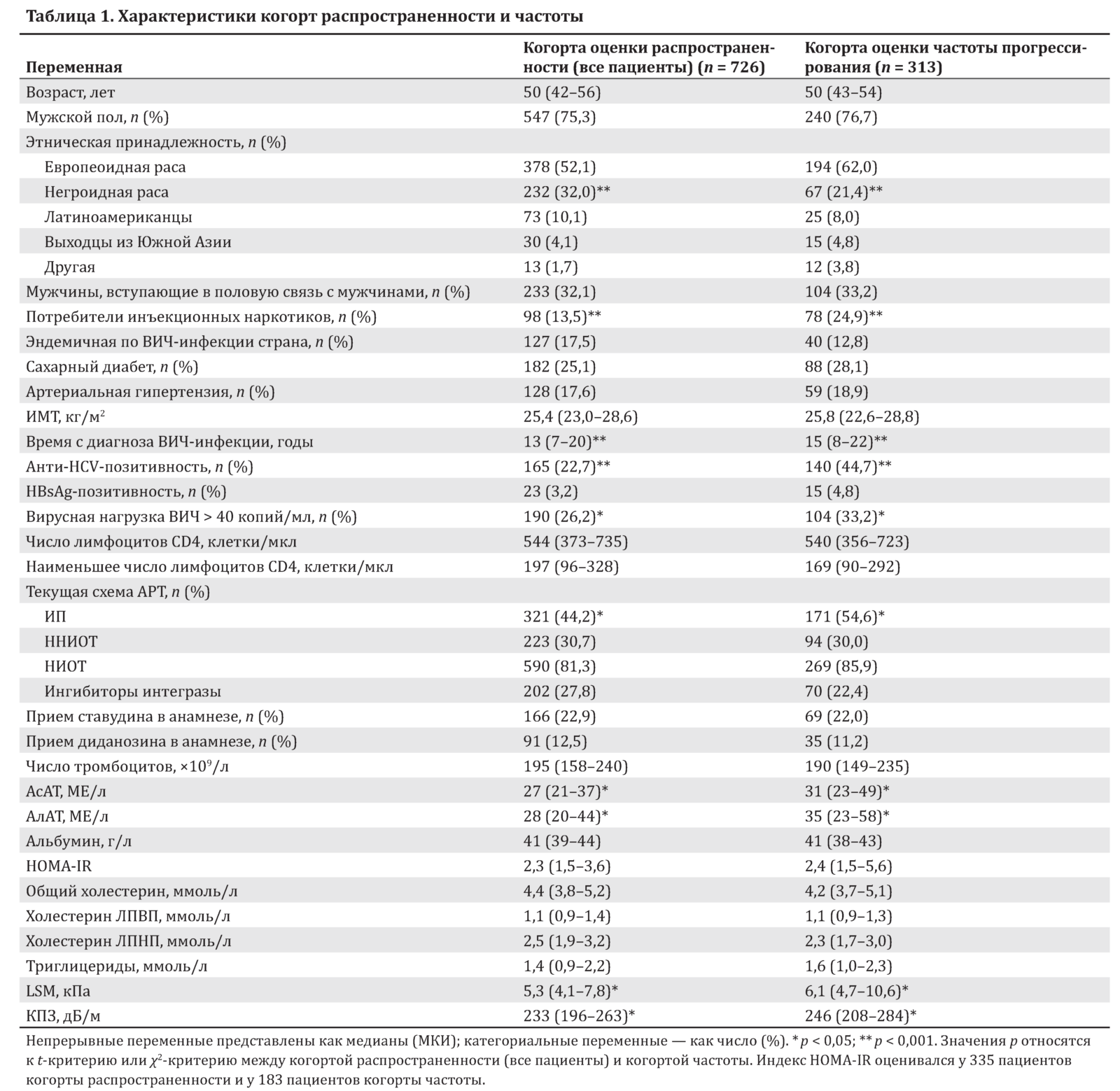
Результаты. Проведено проспективное когортное исследование, включавшее 726 ВИЧ-инфицированных пациентов (22,7 % — со смешанной инфекцией ВИЧ/HCV). Распространенность стеатоза любой степени не отличалась между пациентами с моноинфекцией ВИЧ и смешанной инфекцией ВИЧ/HCV (36,1 vs 38,6 % соответственно). 313 пациентов наблюдались в течение медианы 15,4 мес. (межквартильный интервал 8,5–23 мес.).
Частота прогрессирования стеатоза составила 37,8 (95%-й доверительный интервал [95% ДИ] 29,2–49,0) и 21,9 (95% ДИ 15,6–30,7) на 100 человеко-лет при моноинфекции ВИЧ и смешанной инфекции ВИЧ/HCV соответственно. Наличие гепатита C у ВИЧ-инфицированных было независимым негативным предиктором прогрессирования стеатоза (скорректированное отношение рисков [СОР] 0,50; 95% ДИ 0,28–0,89).
Стеатоз был прогностическим фактором прогрессирования фиброза печени при моноинфекции ВИЧ (СОР 4,18; 95% ДИ 1,21–14,5), но не при смешанной инфекции ВИЧ/HCV.
Выводы. Стеатоз печени прогрессирует быстрее и связан с прогрессированием фиброза печени при моноинфекции ВИЧ, но не при смешанной инфекции ВИЧ/HCV.
Резюме. Ожирение печени — одно из самых частых заболеваний печени в западных странах. ВИЧ-инфицированные, по-видимому, находятся в группе высокого риска по ожирению печени вследствие частых нарушений обмена и долгосрочных эффектов антиретровирусной терапии. Однако из-за инвазивности биопсии печени, традиционного метода диагностики ожирения печени, данных о ее распространенности среди ВИЧ-инфицированных немного.
В настоящем исследовании мы использовали неинвазивный диагностический инструмент для анализа эпидемиологии ожирения печени у 726 ВИЧ-инфицированных пациентов. Мы обнаружили, что ожирение печени имеет место более чем у 1/3 ВИЧ-инфицированных. При наблюдении в течение времени мы выяснили, что у ВИЧ-инфицированных пациентов без сопутствующего гепатита C ожирение печени развивается чаще, чем у лиц со смешанной инфекцией ВИЧ/HCV.
Ключевые слова: моноинфекция ВИЧ, смешанная инфекция ВИЧ/HCV, стеатоз печени, фиброз печени, ультразвуковая эластография, плотность печени, контролируемый параметр затухания, распространенность, частота.
Сокращения: 95% ДИ — 95% доверительный интервал; HCV — вирус гепатита C; HOMA-IR — гомеостатическая модель для оценки инсулинорезистентности; LSM — измерение плотности печени; АлАТ — аланинаминотрансфераза; АРТ — антиретровирусная терапия; АсАТ — аспартатаминотрансфераза; ИМТ — индекс массы тела; ИП — ингибиторы протеазы; КПЗ — контролируемый параметр затухания; ЛПВП — липопротеиды высокой плотности; ЛПНП — липопротеиды низкой плотности; МКИ — межквартильный интервал; МРТ — магнитно-резонансная томография; НИОТ — нуклеозидные ингибиторы обратной транскриптазы; ННИОТ — ненуклеозидные ингибиторы обратной транскриптазы; ОР — отношение рисков; СОР — скорректированное отношение рисков; УЭ — ультразвуковая эластография.
Введение
Стеатоз печени — это накопление жира в печени, которое может в конечном итоге прогрессировать до стеатогепатита, патологического воспалительного ответа, ведущего к фиброзу, циррозу и печеночной недостаточности [1]. Стеатоз печени особенно часто встречается при гепатите C у ВИЧ-инфицированных пациентов; по сообщениям, частота варьирует от 30 до 70 % [2–6].
Вирус гепатита C (HCV) индуцирует стеатоз за счет нескольких механизмов, включая изменение жирового обмена, метаболические факторы риска при инфекциях и прямой стеатогенный эффект HCV генотипа 3 [7]. Продольные исследования дали противоречивые результаты в отношении роли стеатоза в ускорении прогрессирования фиброза печени при смешанной инфекции ВИЧ/HCV [8, 9].
Данных о стеатозе при моноинфекции ВИЧ без гепатита C немного. Моноинфекция ВИЧ является фактором риска стеатоза за счет нескольких предполагаемых механизмов, включая частые метаболические нарушения и гепатотоксичный эффект антиретровирусной терапии (АРТ) [3]. Более того, сам по себе ВИЧ связан с хроническим воспалением и иммунной активацией, что делает дополнительный вклад в развитие прогрессирующего стеатоза и стеатогепатита [10, 11]. Популяционные исследования сообщали о более высокой распространенности стеатоза у ВИЧ-инфицированных, чем среди населения в целом [2–5]. Однако недавнее исследование, использующее магнитно-резонансную томографию (МРТ) и спектроскопию, позволило предположить, что стеатоз встречается чаще у неинфицированных взрослых, чем при моноинфекции ВИЧ и смешанной инфекции ВИЧ/HCV [7].
Эти противоречивые результаты могут быть следствием различных определений и техник, используемых для диагностики стеатоза, популяционного дизайна исследования и возможности систематической ошибки учета выживаемости. Учитывая, что стеатоз — это хронический процесс, необходимы продольные исследования, оценивающие динамику стеатоза и его влияние на прогрессирование фиброза печени у ВИЧ-инфицированных, особенно у лиц с моноинфекцией ВИЧ.
Однако биопсия печени — «золотой стандарт» диагностики стеатоза и фиброза — несет значительные риски и не подходит для крупных скрининговых программ [12]. Более того, из-за отсутствия четких клинических показаний исследования на основе биопсии с повторным измерением спустя время очень сложны в проведении, особенно у пациентов с моноинфекцией ВИЧ без систематической ошибки отбора.
Введение ультразвуковой эластографии (УЭ) — неинвазивного инструмента, который измеряет плотность печени как суррогатный показатель фиброза печени, создает новые возможности для исследований. Контролируемый параметр затухания (КПЗ) определяет степень ослабления ультразвукового сигнала жиром печени (FibroScan, Echosens, Франция) одновременно с измерением плотности печени (LSM). УЭ и КПЗ были валидизированы для диагностики стеатоза и фиброза печени у ВИЧ-инфицированных [13].
Мы создали когорту LIVEHIV (болезни печени при ВИЧ-инфекции) — первую северо-американскую проспективную когорту, разработанную, чтобы охарактеризовать эпидемиологию, динамику и влияние на фиброз печени стеатоза у ВИЧ-инфицированных взрослых, проходящих рутинную скрининговую программу с УЭ и связанным КПЗ.
Цели настоящего исследования: 1) изучить распространенность и связанные кофакторы стеатоза и значительного фиброза печени; 2) изучить частоту и предикторы стеатоза и прогрессирования фиброза печени у ВИЧ-инфицированных с гепатитом C или без него.
Пациенты и методы
Дизайн исследования и участники
Когортное исследование LIVEHIV — проспективная рутинная скрининговая программа оценки стеатоза и фиброза печени, созданная в сентябре 2013 г. в Центре здоровья McGill University (MUHC), Монреаль, Канада. На сентябрь 2016 г. в когорту LIVEHIV было набрано 1173 пациента, все они прошли скрининг на заболевания печени, включая серологические исследования на гепатиты C и B, идентификационный опросник на нарушения, связанные со злоупотреблением алкоголя (AUDIT-C) [14] и ежегодную УЭ с КПЗ.
Пациенты, включенные в настоящий анализ, отвечали следующим критериям: 1) возраст 18 лет и старше; 2) ВИЧ-инфекция по позитивному результату твердофазного иммуноферментного анализа (ELISA) с иммуноблоттингом; 3) доступны соответствующие клинические и биохимические показатели; 4) хотя бы один надежный результат LSM с КПЗ.
Критерии исключения: 1) наличие других заболеваний печени (аутоиммунного гепатита, гемохроматоза, болезни Вильсона); 2) злоупотребление алкоголем (AUDIT-C ≥ 7 баллов [14]; 3) анамнез или наличие гепатоцеллюлярного рака либо трансплантация печени на момент набора; 4) неудача исследования УЭ или ненадежное определение LSM; 5) противопоказания к проведению УЭ (беременность, установленный водитель ритма).
У каждого участника исследования было получено информированное согласие. Этическая комиссия по исследованиям Научно-исследовательского института MUHC одобрила исследование (код 14-181-BMD), которое было проведено в соответствии с Хельсинкской декларацией.
Оценка исходов и определение групп исследования
Основные оцениваемые показатели исследования были следующими: 1) распространенность и связанные кофакторы стеатоза любой степени и значительного фиброза печени; 2) частота и предикторы прогрессирования стеатоза и фиброза печени. На основе недавнего метаанализа и предыдущих исследований стеатоз любой степени (захватывающий > 10 % гепатоцитов) и тяжелый стеатоз (захватывающий > 66 % гепатоцитов) были определены как КПЗ ≥ 248 и > 292 дБ/м соответственно [15, 16].
Прогрессирование стеатоза печени определялось как развитие стеатоза любой степени или переход к тяжелому стеатозу у лиц с исходным КПЗ < 292 дБ/м; прогрессирование фиброза печени — как развитие значительного фиброза печени (стадия F2–4, определяемая как LSM > 7,1 кПа) или переход к циррозу (стадия F4, определяемая как LSM > 12,5 кПа) для лиц с исходной LSM > 7,1, но < 12,5 кПа [17].
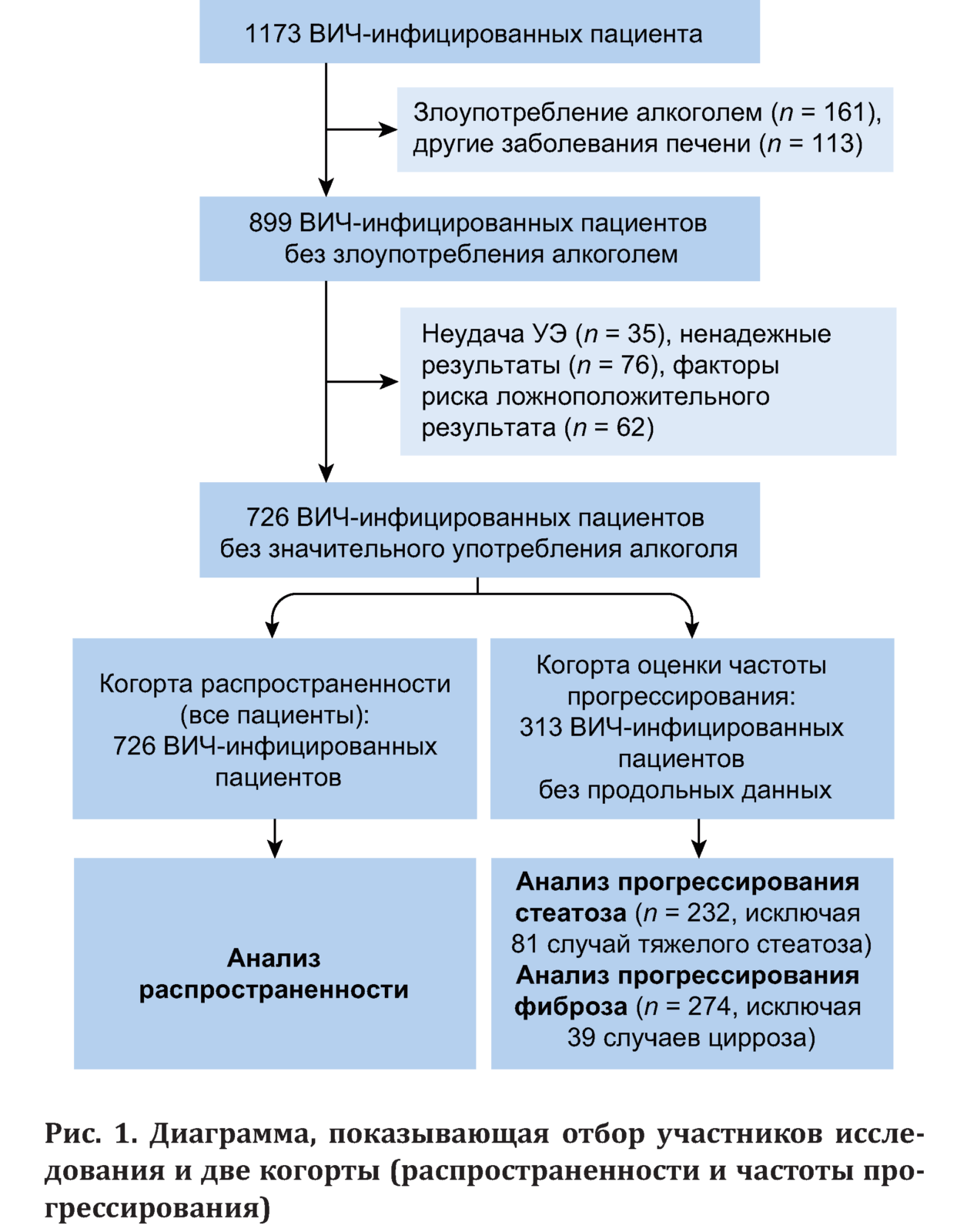
Дополнительно оценивалась распространенность тяжелого стеатоза и цирроза. Когорта исследования была разделена на две группы: 1) когорта оценки распространенности (когорта всего исследования) из 726 пациентов с одним пригодным исследованием УЭ и исходным визитом между сентябрем 2013 г. и сентябрем 2016 г.; 2) когорта оценки частоты прогрессирования, включающая 313 пациентов более чем с одной УЭ с измерением КПЗ в тот же период исследования (рис. 1).
Проведение ультразвуковой эластографии
Исследование проводилось после 4-часового голодания. Два опытных оператора (> 500 исследований) проводили 10 качественных замеров, как описано ранее [2]. У всех пациентов использовался стандартный датчик M. В случае неудачи с датчиком M и если индекс массы тела (ИМТ) превышал 30 кг/м2, применялся датчик XL. Безуспешные исследования после 10 замеров считались неудачей.
Надежный результат измерения отвечал следующим критериям: по крайней мере 10 валидизированных измерений, межквартильный интервал (МКИ) < 30 % медианы и частота успеха > 60 % [18]. Пациенты с известными факторами риска ложноположительного результата LSM также исключались [18]. Пороги для фиброза печени были снижены на 1,5 кПа, чтобы интерпретировать результаты, полученные с помощью датчика XL [19].
Клинические и биологические параметры
Соответствующие данные собирались в течение 3 мес. от УЭ. Клинические параметры включали возраст, пол, этническую принадлежность, ИМТ, анамнез гипертензии или сахарного диабета 2-го типа, факторы риска ВИЧ-инфекции, время с постановки диагноза ВИЧ-инфекции, получение АРТ. Препараты АРТ классифицировали на ингибиторы протеазы (ИП), ненуклеозидные ингибиторы обратной транскриптазы (ННИОТ), нуклеоз(т)идные ингибиторы обратной транскриптазы (НИОТ) и ингибиторы интегразы.
Биологические параметры включали число лимфоцитов CD4, вирусную нагрузку ВИЧ (Roche Cobas Amplicor assay, Roche Diagnostics, Hoffmann-La Roche Ltd, нижний предел определения — 40 копий/мл), уровень РНК HCV (Roche Cobas Amplicor HCV Test версии 2.0, Roche Diagnostics, Hoffmann-La Roche Ltd), генотип HCV, активность аспартатаминотрансферазы (АсАТ), аланинаминотрансферазы (АлАТ), число тромбоцитов, уровень общего холестерина, уровень холестерина липопротеидов низкой плотности (ЛПНП) и холестерина липопротеидов высокой плотности (ЛПВП), уровень триглицеридов. Инсулинорезистентность определялась с помощью индекса гомеостатической модели для оценки инсулинорезистентности (HOMA-IR) [уровень инсулина натощак (мМЕ/л) × уровень глюкозы натощак (ммоль/л) / 22,5] [20].
Статистический анализ
Исходный уровень (нулевая точка) соответствовал первому визиту после 1 сентября 2013 г., когда проводилась УЭ. Мы сравнивали характеристики участников в начале исследования с использованием t-критерия Стьюдента для непрерывных переменных и χ2-критерия Пирсона или точного критерия Фишера для категориальных переменных.
Чтобы установить кофакторы, независимо связанные со стеатозом любой степени и значительным фиброзом печени в когорте распространенности, были построены многофакторные логистические регрессионные модели. Результаты были представлены в виде скорректированных отношений рисков (СОР) с 95%-ми доверительными интервалами (95% ДИ).
Пациентов в когорте оценки частоты прогрессирования наблюдали до сентября 2016 г. или цензурировали в случае смерти либо при последнем клиническом визите. Мы оценивали частоту прогрессирования стеатоза и фиброза печени путем деления количества участников, у которых развился такой исход, на количество человеко-лет наблюдения. Для вычисления ДИ для частоты использовались расчетные модели Пуассона.
Для иллюстрации времени до прогрессирования стеатоза и фиброза использовались графики Каплана—Мейера и лог-ранговые критерии. Для оценки предикторов прогрессирования стеатоза и фиброза были созданы многофакторные зависимые от времени регрессионные модели Кокса. Результаты были представлены в виде СОР с 95% ДИ. Чтобы учесть корреляцию данных, предоставленных одним и тем же участником в разные визиты, во всех регрессионных анализах Кокса использовалась надежная оценка отклонений.
Многофакторные модели включали ковариаты, которые были априори признаны клинически важными, а именно: возраст, негроидная раса, статус по смешанной инфекции с HCV, время от постановки диагноза ВИЧ-инфекции, ИМТ, определяемая вирусная нагрузка ВИЧ, определяемый уровень РНК HCV, активность АлАТ, уровень триглицеридов, КПЗ.
Для многофакторных моделей использовался комплексный анализ случаев, и доля отсутствующих данных была менее 15 %, если не указано иное. Все критерии были двусторонними и имели уровень значимости α = 0,05. Статистические анализы проводились на программном обеспечении STATA 13.1 (STATA Corp. LP, США).
Результаты
После применения критериев исключения (см. рис. 1) в когорту оценки распространенности было включено 726 ВИЧ-инфицированных пациентов. Частота неудач при УЗ (19,2 %) согласовывалась с данными предыдущих исследований [18]. XL-датчик использовался у 159 (22 %) пациентов, у остальных пациентов применялся M-датчик.
Характеристики когорты распространенности (всей группы пациентов) и когорты частоты приведены в табл. 1. В когорте распространенности употребление алкоголя было распределено следующим образом: 208 (28,7 %) не употребляли алкоголь (AUDIT-C 0 баллов), 359 (49,4 %) употребляли алкоголь мало (AUDIT-C 1–3 балла) и 159 (21,9 %) — умеренно (AUDIT-C 4–6 баллов).
Большинство пациентов получали АРТ. 11 (1,5 %) и 6 (1,9 %) пациентов имели смешанную инфекцию ВИЧ/HCV и ВИЧ/HCV/HBV соответственно. В дополнительной табл. S1 приложения показаны основные характеристики когорты распространенности (всех пациентов) по статусу смешанной инфекции с HCV. Среди пациентов со смешанной инфекцией ВИЧ/HCV РНК HCV определялась в 105 (63,6 %) случаях, 30 (18,2 %) пациентов были инфицированы HCV генотипа 3.
Распространенность и связанные с ней кофакторы стеатоза и фиброза печени в когорте оценки распространенности
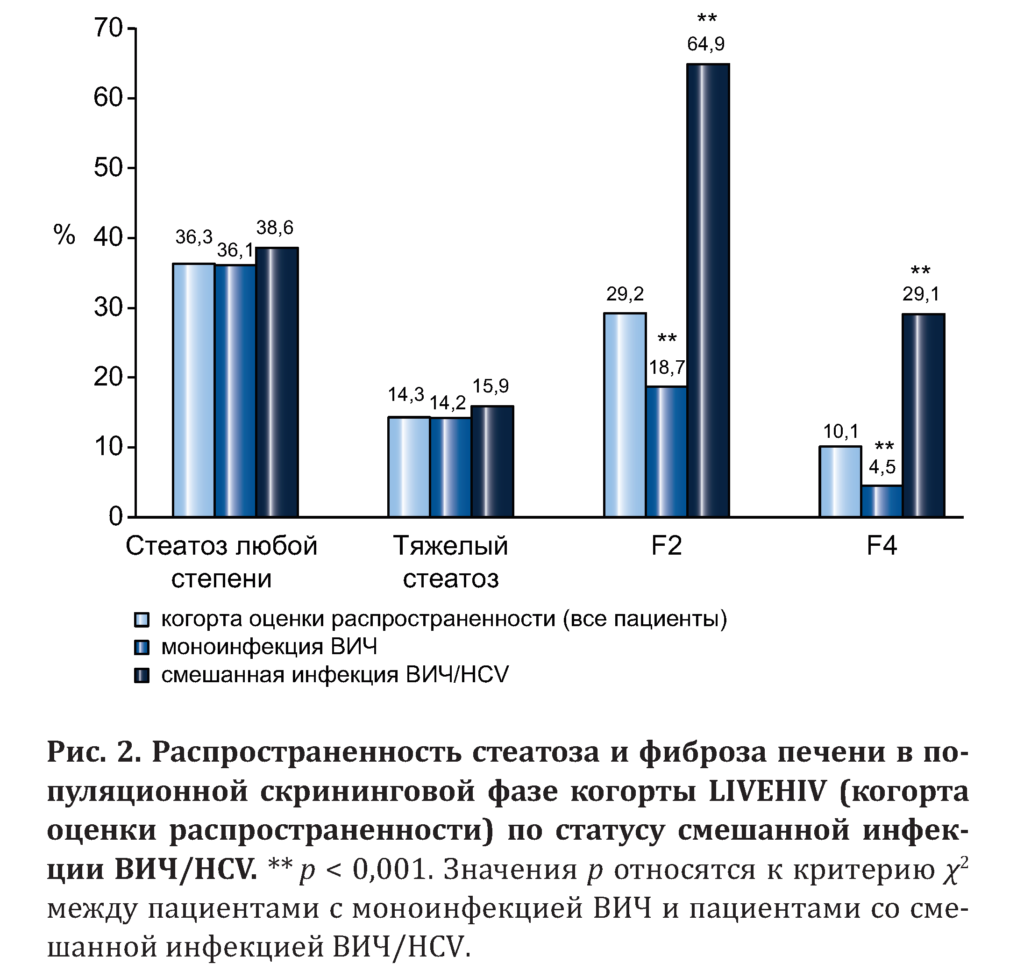
Результаты популяционной скрининговой фазы когорты LIVEHIV представлены на рис. 2. Всего 264 (36,4 %) и 212 (29,2 %) пациентов имели стеатоз любой степени и значительный фиброз печени соответственно. Значительных различий в распространенности стеатоза любой степени или тяжелого стеатоза между пациентами с моноинфекцией ВИЧ и смешанной инфекцией ВИЧ/HCV не было. На дополнительном рис. S1a приложения показана медиана значений КПЗ в когорте распространенности по статусу смешанной инфекции с HCV.
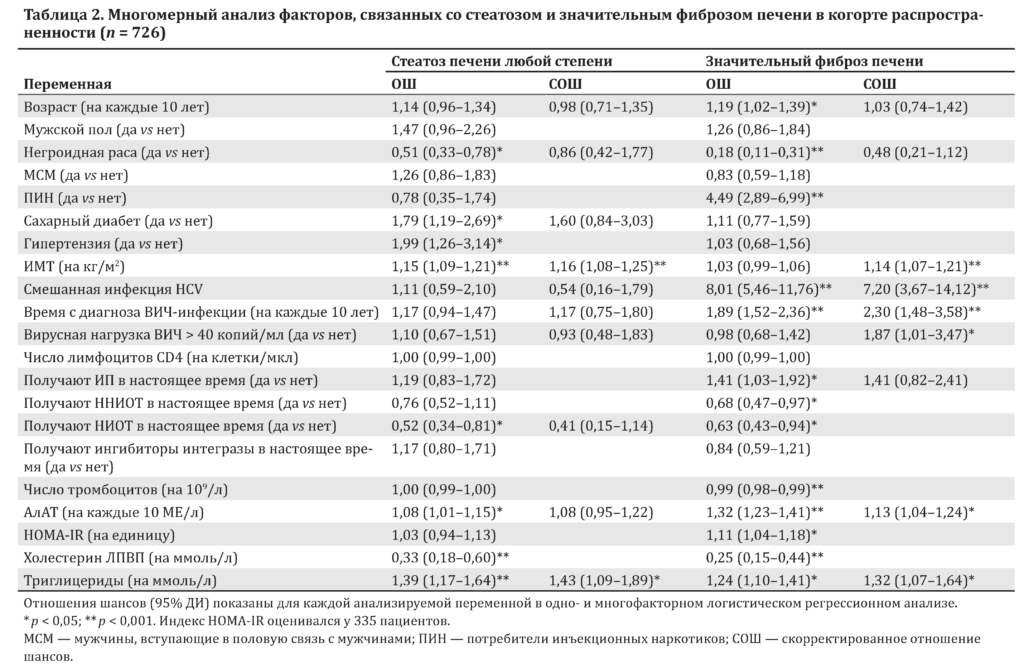
В табл. 2 приведены результаты многофакторного анализа кофакторов, связанных со стеатозом любой степени и значительным фиброзом печени в когорте распространенности. После коррекции более высокие ИМТ и уровень триглицеридов были независимо связаны со стеатозом любой степени.
Независимыми кофакторами значительного фиброза печени были более высокий ИМТ, смешанная инфекция с HCV, большее время с постановки диагноза ВИЧ-инфекции, определяемая вирусная нагрузка ВИЧ, более высокая активность АлАТ и более высокий уровень триглицеридов. Добавление HOMA-IR к двум моделям не изменило результаты, и мы решили не включать ее вследствие незначимости.
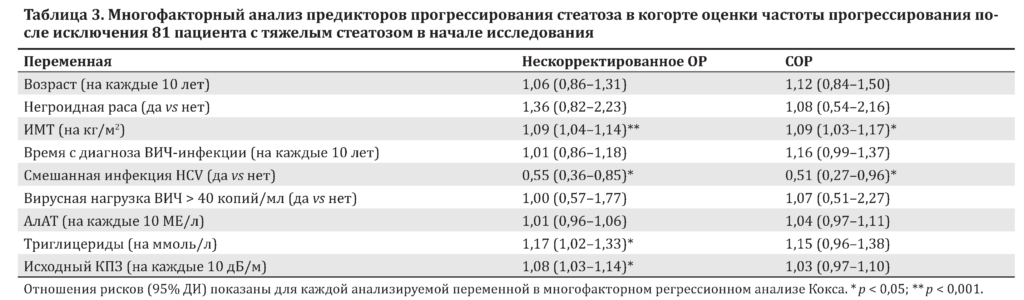
Частота и предикторы прогрессирования стеатоза в когорте оценки частоты прогрессирования
81 (25,9 %) пациент из когорты частоты прогрессирования был исключен из анализа из-за исхода (тяжелого стеатоза) в начале исследования. Остальных 232 пациентов наблюдали в течение медианы 15,4 (МКИ 8,5–23,0) мес.
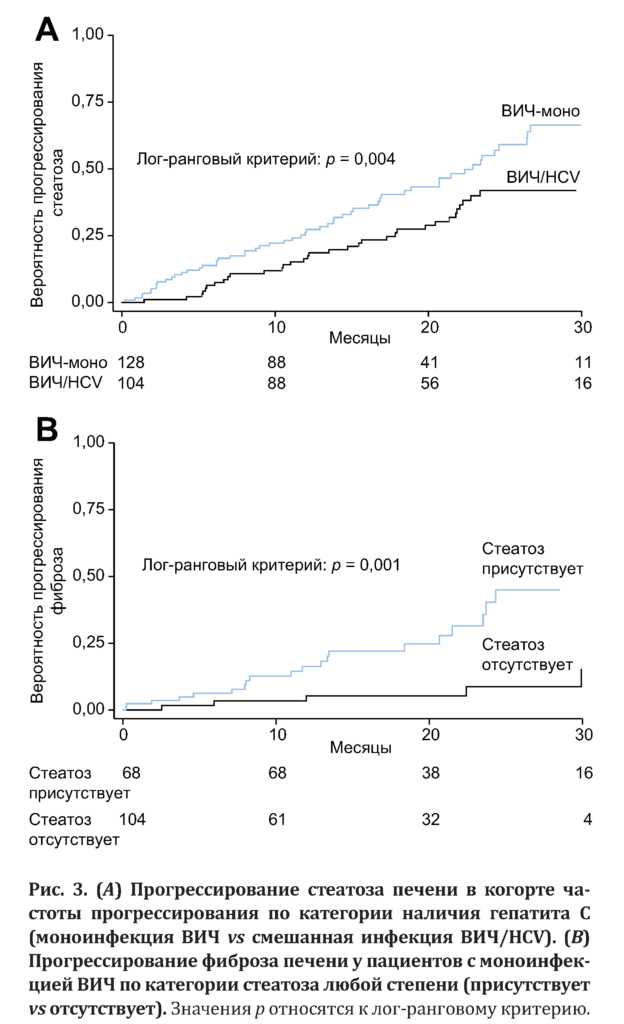
На дополнительном рис. S1b приложения показана медиана значений КПЗ в когорте частоты по статусу смешанной инфекции с HCV во время периода наблюдения. Всего 97 (41,8 %) имели прогрессирование стеатоза, что составило 29,7 случая на 100 человеко-лет (95% ДИ 24,2–36,5). У пациентов с моноинфекцией ВИЧ частота прогрессирования стеатоза (37,8 на 100 человеко-лет; 95% ДИ 29,2–49,0) была выше по сравнению с пациентами со смешанной инфекцией ВИЧ/HCV (21,9 на 100 человеко-лет; 95% ДИ 15,6–30,7; рис. 3, A).
Различий в частоте прогрессирования стеатоза по статусу определяемой РНК HCV или генотипу 3 HCV не было (см. дополнительные рис. S2а и S2b приложения соответственно). Для понимания величины динамики стеатоза со временем мы также рассмотрели прогрессирование стеатоза более чем на 1 степень и регрессирование стеатоза.
На дополнительном рис. S3а приложения представлены изменения стеатоза по статусу смешанной инфекции с HCV. После коррекции предиктором прогрессирования стеатоза стал более высокий исходный ИМТ, тогда как анти-HCV-позитивность была отрицательным предиктором (табл. 3).
Более длительное время с момента постановки диагноза ВИЧ-инфекции и более высокий уровень триглицеридов также, по-видимому, были связаны, но не достигли статистической значимости.
Частота и предикторы прогрессирования фиброза печени в когорте оценки частоты прогрессирования
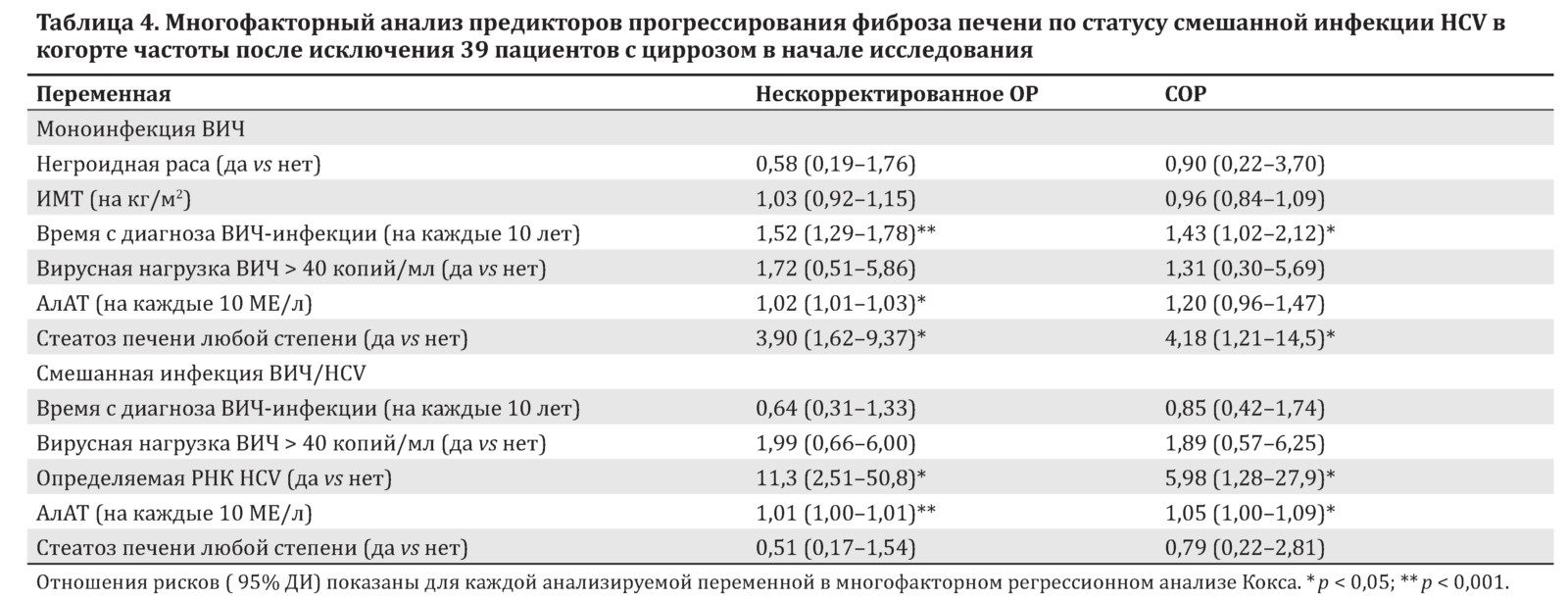
39 (12,5 %) пациентов из когорты частоты прогрессирования были исключены из анализа из-за цирроза в начале исследования. Из остальных 274 пациентов 53 (19,3 %) имели прогрессирование фиброза, составляющее 12,7 случая на 100 человеко-лет (95% ДИ 9,5–17,1). Значительных различий в прогрессировании фиброза у пациентов со стеатозом любой степени или без него не было.
Однако при анализе только пациентов с моноинфекцией ВИЧ наличие vs отсутствие стеатоза любой степени были связаны с более высокой частотой прогрессирования фиброза (20,4 на 100 человеко-лет, 95% ДИ 13,2–31,6 vs 5,8 на 100 человеко-лет, 95% ДИ 2,6–13,0; рис. 3, B). На дополнительных рис. S3b и S3c приложения показаны изменения фиброза печени по статусу стеатоза у пациентов с моноинфекцией ВИЧ и смешанной инфекцией ВИЧ/HCV соответственно.
У пациентов с моноинфекцией ВИЧ прогрессирование фиброза было независимо связано с более длительным временем после диагноза ВИЧ-инфекции и со стеатозом любой степени в начале исследования (табл. 4). У пациентов со смешанной инфекцией ВИЧ/HCV определяемая РНК HCV и более высокая активность АлАТ были независимыми предикторами прогрессирования фиброза.
Обсуждение
Используя крупную проспективную когорту ВИЧ-инфицированных пациентов, проходивших рутинную скрининговую программу, мы обнаружили, что стеатоз, диагностированный с помощью УЭ с КПЗ, является частым сопутствующим заболеванием. В отличие от предыдущих сообщений в когорте ВИЧ/HCV стеатоз был распространен не больше, чем в когорте пациентов с моноинфекцией.
Более того, стеатоз прогрессировал быстрее у лиц с моноинфекцией ВИЧ, чем у лиц со смешанной инфекцией ВИЧ/HCV, особенно у тех, кто имел избыточную массу тела. Этот факт подчеркивает, как важно наблюдать за развитием поражения печени со временем, которое побуждает к оценке частоты, динамики и предикторов, нежели полагаться на разовую оценку для характеристики его эпидемиологии.
Стеатоз служит прогностическим фактором прогрессирования фиброза печени у пациентов с моноинфекцией ВИЧ, но не у пациентов со смешанной инфекцией ВИЧ/HCV, по-видимому отражая глубокие патофизиологические различия (метаболические vs индуцированные вирусом) в процессе фиброгенеза между двумя клиническими популяциями.
У пациентов с моноинфекцией ВИЧ и смешанной инфекцией ВИЧ/HCV был отмечен широкий диапазон распространенности стеатоза. Исследования с низкой распространенностью стеатоза (11–19 %) включали больше женщин и лиц с отсутствием или минимальным употреблением алкоголя [7, 9].
C другой стороны, исследования, сообщающие о высокой распространенности стеатоза у ВИЧ-инфицированных пациентов (60–73 %), включали в основном мужчин или лиц, злоупотреблявших алкоголем [6, 8]. Эти исследования были обречены на ошибки отбора, поскольку они оценивали стеатоз по биопсии печени или включали только пациентов с повышенной активностью аминотрансфераз.
Распространенность стеатоза, по нашим данным, 36,1 % у пациентов с моноинфекцией ВИЧ и 38,6 % у пациентов со смешанной инфекцией ВИЧ/HCV согласуется с предыдущими исследованиями в ВИЧ-положительных популяциях с низким уровнем избыточного употребления алкоголя и типичной долей мужчин (~70 %) в западных странах [3, 5, 21]. Более того, эти цифры выше, чем среди населения Канады в целом, где распространенность стеатоза составляет 20–25 % [22].
Важно, что, хотя предыдущие исследования позволяют предположить более высокую распространенность стеатоза у пациентов со смешанной инфекцией ВИЧ/HCV по сравнению с пациентами с моноинфекцией ВИЧ, в нашей рутинной скрининговой программе мы не обнаружили таких различий.
Напротив, наши данные подтверждают недавние находки Price et al. [7], что стеатоз у лиц с моноинфекцией ВИЧ может быть индуцирован несколькими предполагаемыми механизмами, включая прямое воздействие вируса на липогенез, длительную АРТ, метаболические нарушения и хроническое воспаление [10, 23]. Что до пациентов со смешанной инфекцией ВИЧ/HCV, HCV генотипа 3 обладает прямыми стеатогенными свойствами [24, 25] и стеатоз уменьшается при эрадикации вируса [26, 27].
Механизмы, ответственные за стеатоз при гепатите C других генотипов, связаны с метаболическими факторами, как и при моноинфекции ВИЧ [28, 29]. Подтверждая решающую роль метаболических нарушений в развитии стеатоза в контексте ВИЧ-инфекции, основными факторами, связанными с распространенностью стеатоза, были более высокие ИМТ и уровень триглицеридов.
Существуют также независимые предикторы распространенности значительного фиброза печени наряду с другими ожидаемыми факторами, а именно: смешанная инфекция с HCV, более длительное время с постановки диагноза ВИЧ-инфекции и более высокая активность АлАТ. Мы и другие авторы показали, что ИМТ — главный предиктор распространенности стеатоза у ВИЧ-инфицированных пациентов [2, 30], что позволяет предположить важность поддержания нормальной массы тела.
Еще одно свидетельство популяционной фазы когорты LIVEHIV: значительный фиброз печени и цирроз очень часто встречаются у последовательных пациентов с моноинфекцией ВИЧ, проходящих рутинную скрининговую программу. Наши данные подтверждают результаты, полученные в более мелких исследованиях в западных странах [2, 4]. Это должно повысить понимание врачами растущего бремени заболеваний печени у пациентов с моноинфекцией ВИЧ вследствие старения, метаболических нарушений и связанного ожирения печени.
Удивительно, что пациенты с моноинфекцией ВИЧ имеют значительно более высокую частоту прогрессирования стеатоза, чем пациенты со смешанной инфекцией ВИЧ/HCV. Продольные исследования, оценивающие частоту стеатоза в контексте ВИЧ-инфекции, немногочисленны, особенно в отношении пациентов с моноинфекцией ВИЧ.
В исследовании у 146 пациентов со смешанной инфекцией ВИЧ/HCV с парной биопсией печени прогрессирование до стеатоза наблюдалось в 40 % случаев через период наблюдения с медианой 3,3 (диапазон 2,0–5,2) года, что согласуется с нашими данными [8]. Однако динамика стеатоза у пациентов с моноинфекцией ВИЧ не оценивалась в проспективных исследованиях. Механистическое объяснение, лежащее в основе наших данных, — по-видимому, многофакторное.
Пациенты с моноинфекцией ВИЧ имеют другие исходные клинические характеристики по сравнению с пациентами со смешанной инфекцией ВИЧ/HCV, особенно по части более высокой частоты метаболических нарушений и более высокого ИМТ, который был самым сильным предиктором прогрессирования стеатоза.
Более того, лица со смешанной инфекцией ВИЧ/HCV имеют другой липидный профиль в отличие от лиц с моноинфекцией ВИЧ, включая более низкие уровни общего холестерина, холестерина ЛПВП и ЛПНП. Для пациентов со смешанной инфекцией ВИЧ/HCV был недавно предложен термин «липидный парадокс», т. е., несмотря на повышение активности пропротеинов при смешанной инфекции ВИЧ/HCV, что в целом ведет к повышению уровня сывороточного холестерина ЛПНП, уровень ЛПНП остается низким [31].
Это, по-видимому, обусловлено глубоким хроническим воспалительным состоянием, характеризующим смешанную инфекцию ВИЧ/HCV, которое может влиять на способность печени синтезировать липопротеиды. Наконец, учитывая, что фиброз печени прогрессирует быстрее у больных со смешанной инфекцией ВИЧ/HCV, более медленное прогрессирование стеатоза может отчасти объясняться потерей жиров из-за высокой частоты выраженного фиброза [32]. В многофакторном анализе ИМТ и моноинфекция ВИЧ были единственными независимыми предикторами прогрессирования стеатоза.
Влияние ИМТ на динамику стеатоза, измеренного с помощью КПЗ, уже предполагалось Macias et al. [21]. Однако период наблюдения у них был короче, чем в нашем исследовании, и большинство включенных пациентов (74 %) имели смешанную инфекцию ВИЧ/HCV, так что прямое сравнение с пациентами с моноинфекцией ВИЧ не проводилось.
Продольная фаза исследования когорты LIVEHIV позволила нам охарактеризовать влияние стеатоза на фиброз печени. О частоте и предикторах фиброза печени у пациентов с моноинфекцией ВИЧ сообщалось в других 3 исследованиях. Однако все они использовали простые сывороточные биомаркеры, которые имеют меньшую диагностическую точность, чем УЭ [18].
Более того, ни в одном из них не было показано влияние стеатоза на прогрессирование фиброза печени [33–35]. Наши данные демонстрируют, что стеатоз и длительность контакта с ВИЧ — независимые предикторы прогрессирования фиброза у пациентов с моноинфекцией ВИЧ. С другой стороны, стеатоз не был связан с прогрессированием фиброза у лиц со смешанной инфекцией ВИЧ/HCV.
Индуцированный вирусом фиброгенез, некроз и воспаление имеют важное значение в этих условиях, как показывает тот факт, что определяемая РНК HCV и повышение активности АлАТ были прогностическими факторами прогрессирования фиброза. Это согласуется с предыдущими данными о том, что стеатогепатит (но не стеатоз), некроз и воспаление связаны с прогрессированием фиброза у пациентов со смешанной инфекцией ВИЧ/HCV [8]. Действительно, пациенты со смешанной инфекцией ВИЧ/HCV получают наибольшее преимущество от эрадикации HCV с помощью противовирусной терапии [26, 27].
Наше исследование имело несколько сильных сторон. Насколько нам известно, это первое проспективное исследование, оценивающее динамику стеатоза и показывающее его связь с прогрессированием фиброза у лиц с моноинфекцией ВИЧ. Более того, мы включали последовательных пациентов как часть идущей в нашем центре скрининговой программы. Дизайн этого исследования сводит к минимуму риск ошибки отбора, которая могла иметь место в предыдущих исследованиях, отбирающих больных с повышенной активностью аминотрансфераз.
Но следует признать и ряд ограничений нашего исследования. Во-первых, мы не включали контрольную группу из населения Канады для прямого сравнения. Во-вторых, мы не подтверждали стеатоз гистологическим исследованием или МРТ-спектроскопией. Однако проводить биопсию у пациентов, не имеющих клинических нарушений, не оправдано.
МРТ-спектроскопия не подходит для скрининга больших количеств пациентов и не рекомендуется для рутинного клинического использования [36]. В-третьих, УЭ может переоценивать фиброз при тяжелом стеатозе [37]. В то же время после коррекции небольшого количества случаев на риск неточности изменений в наших результатах не было (данные не приводятся).
Точно так же, когда мы проводили коррекцию значений КПЗ, предложенную Karlas et al., медиана КПЗ не изменилась значительно и только у 6 % когорты повысилась или понизилась степень стеатоза [16]. В-четвертых, вследствие относительно короткого периода наблюдения мы не смогли изучить влияние специфических препаратов АРТ на стеатоз и фиброз печени. Наконец, мы не смогли выделить пациентов с неалкогольным стеатогепатитом — эволюционным аналогом стеатоза. Точные неинвазивные методы, способные диагностировать неалкогольный стеатогепатит, все еще отсутствуют, и это должно стать предметом будущих исследований.
Итак, наше исследование продемонстрировало, что стеатоз часто сопутствует ВИЧ-инфекции. У пациентов с моноинфекцией ВИЧ стеатоз прогрессирует быстрее, чем у пациентов со смешанной инфекцией ВИЧ/HCV. У больных с моноинфекцией, но не у больных со смешанной инфекцией стеатоз связан с прогрессированием фиброза.
Лица с высоким ИМТ имеют особенно высокий риск прогрессирования стеатоза и требуют потенциального вмешательства. Оправданы дальнейшие долгосрочные исследования для оценки влияния стеатоза и фиброза печени на клинические исходы.
Спонсоры
Компании ViiV и Merck предоставили грант для открытия диагностического центра фиброза и стеатоза печени при медицинском центре McGill University.
TP является получателем стартового гранта за клинические лекции от Академии медицинских наук/Фонда поддержки (Великобритания) и стипендии по клинической гепатологии Канадской ассоциации изучения печени. GS и BL являются получателями карьерной премии исследователей-стипендиатов от Исследовательского фонда Квебека — Здоровье (FRQ-S). MBK является получателем национальной исследовательской карьерной премии от FRQ-S. Частично эта работа была представлена на встрече по заболеваниям печени Американской ассоциации по изучению болезней печени в 2016 г.
Конфликты интересов
BL выступал консультантом для компаний ViiV, Gilead и Merck, получал финансирование исследований от Merck, Gilead и Abbvie. MD участвовал в консультативных комиссиях для Merck, Janssen, Gilead. PW выступал консультантом для BMS, Gilead, Merck, Novartis. PG выступал консультантом для Merck и Gilead. MBK выступала консультантом для ViiV, Gilead, Janssen и Merck, получала финансирование исследований от Merck и ViiV. GS выступала в качестве докладчика для Merck, BMS, Gilead, Abbvie, участвовала в консультативных комиссиях для Merck и BMS, получала финансирование исследований от Merck.
TP, AB, MS, AH, EVL, CP конфликтов интересов не имеют.
Вклад авторов
TP — дизайн исследования, данные, интерпретация данных и первый черновик статьи. BL, MS, PG, PW, MD, AH и EVL — данные, интерпретация данных. AB и CP — данные. MBK — концепция, дизайн исследования, данные и интерпретация данных. GS — концепция, дизайн исследования, данные и интерпретация данных, статистический анализ и первый черновик рукописи. Все авторы одобрили окончательную версию статьи.
Дополнительные материалы
Дополнительные материалы к статье представлены в англоязычном приложении на сайте https://dx.doi.org/10.1016/j.jhep.2017.05.011.
Литература
- Angulo P. Nonalcoholic fatty liver disease. N Engl J Med 2002;346:1221–1231.
- Vuille-Lessard E, Lebouche B, Lennox L, Routy JP, Costiniuk CT, Pexos C, et al. Nonalcoholic fatty liver disease diagnosed by transient elastography with controlled attenuation parameter in unselected HIV monoinfected patients. AIDS 2016;30:2635–2643.
- Guaraldi G, Squillace N, Stentarelli C, Orlando G, D’Amico R, Ligabue G, et al. Nonalcoholic fatty liver disease in HIV-infected patients referred to a metabolic clinic: prevalence, characteristics, and predictors. Clin Infect Dis 2008;47:250–257.
- Lombardi R, Sambatakou H, Mariolis I, Cokkinos D, Papatheodoridis GV, Tsochatzis EA. Prevalence and predictors of liver steatosis and fibrosis in unselected patients with HIV mono-infection. Dig Liver Dis 2016;48:1471–1477.
- Crum-Cianflone N, Dilay A, Collins G, Asher D, Campin R, Medina S, et al. Nonalcoholic fatty liver disease among HIV-infected persons. J Acquir Immune Defic Syndr 2009;50:464–473.
- Morse CG, McLaughlin M, Matthews L, Proschan M, Thomas F, Gharib AM, et al. Nonalcoholic steatohepatitis and hepatic fibrosis in HIV-1-monoinfected adults with elevated aminotransferase levels on antiretroviral therapy. Clin Infect Dis 2015;60:1569–1578.
- Price JC, Ma Y, Scherzer R, Korn N, Tillinghast K, Peters MG, et al. HIV-infected and uninfected adults with non-genotype 3 hepatitis C virus have less hepatic steatosis than adults with neither infection. Hepatology 2017;65:853–863.
- Macias J, Berenguer J, Japon MA, Giron-Gonzalez JA, Rivero A, Lopez-Cortes LF, et al. Hepatic steatosis and steatohepatitis in human immunodeficiency virus/hepatitis C virus-coinfected patients. Hepatology 2012;56:1261–1270.
- Woreta TA, Sutcliffe CG, Mehta SH, Brown TT, Higgins Y, Thomas DL, et al. Incidence and risk factors for steatosis progression in adults coinfected with HIV and hepatitis C virus. Gastroenterology 2011;140:809–817.
- Kuller LH, Tracy R, Belloso W, De Wit S, Drummond F, Lane HC, et al. Inflammatory and coagulation biomarkers and mortality in patients with HIV infection. PLoS Med 2008;5 e203.
- Haukeland JW, Damas JK, Konopski Z, Loberg EM, Haaland T, Goverud I, et al. Systemic inflammation in nonalcoholic fatty liver disease is characterized by elevated levels of CCL2. J Hepatol 2006;44:1167–1174.
- Rockey DC, Caldwell SH, Goodman ZD, Nelson RC, Smith AD American Association for the Study of Liver Diseases. Liver biopsy. Hepatology 2009;49:1017–1044.
- Schmid P, Bregenzer A, Huber M, Rauch A, Jochum W, Mullhaupt B, et al. Progression of liver fibrosis in HIV/HCV co-infection: a comparison between non-invasive assessment methods and liver biopsy. PLoS One 2015;10 e0138838.
- Babor TF, Higgins-Biddle JC, Saunders JB, Monteiro MG. Audit. The Alcohol Use Disorders Identification Test (AUDIT): Guidelines for use in primary care; 2001.
- Sasso M, Beaugrand M, de Ledinghen V, Douvin C, Marcellin P, Poupon R, et al. Controlled attenuation parameter (КПЗ): a novel VCTE guided ultrasonic attenuation measurement for the evaluation of hepatic steatosis: preliminary study and validation in a cohort of patients with chronic liver disease from various causes. Ultrasound Med Biol 2010;36:1825–1835.
- Karlas T, Petroff D, Sasso M, Fan JG, Mi YQ, de Ledinghen V, et al. Individual patient data meta-analysis of controlled attenuation parameter (КПЗ) technology for assessing steatosis. J Hepatol 2017;66:1022–1030.
- Castera L, Vergniol J, Foucher J, Le Bail B, Chanteloup E, Haaser M, et al. Prospective comparison of transient elastography, Fibrotest, APRI, and liver biopsy for the assessment of fibrosis in chronic hepatitis C. Gastroenterology 2005;128:343–350.
- Castera L. Noninvasive methods to assess liver disease in patients with hepatitis B or C. Gastroenterology 2012;142:1293–1302 e1294.
- Myers RP, Pomier-Layrargues G, Kirsch R, Pollett A, Duarte-Rojo A, Wong D, et al. Feasibility and diagnostic performance of the FibroScan XL probe for liver stiffness measurement in overweight and obese patients. Hepatology 2012;55:199–208.
- Matthews DR, Hosker JP, Rudenski AS, Naylor BA, Treacher DF, Turner RC. Homeostasis model assessment: insulin resistance and beta-cell function from fasting plasma glucose and insulin concentrations in man. Diabetologia 1985;28:412–419.
- Macias J, Real LM, Rivero-Juarez A, Merchante N, Camacho A, Neukam K, et al. Changes in liver steatosis evaluated by transient elastography with the controlled attenuation parameter in HIV-infected patients. HIV Med 2016;17:766–773.
- Vernon G, Baranova A, Younossi ZM. Systematic review: the epidemiology and natural history of non-alcoholic fatty liver disease and non-alcoholic steatohepatitis in adults. Aliment Pharmacol Ther 2011;34:274–285.
- Lemoine M, Barbu V, Girard PM, Kim M, Bastard JP, Wendum D, et al. Altered hepatic expression of SREBP-1 and PPARgamma is associated with liver injury in insulin-resistant lipodystrophic HIV-infected patients. AIDS 2006;20:387–395.
- Rubbia-Brandt L, Quadri R, Abid K, Giostra E, Male PJ, Mentha G, et al. Hepatocyte steatosis is a cytopathic effect of hepatitis C virus genotype 3. J Hepatol 2000;33:106–115.
- Jackel-Cram C, Babiuk LA, Liu Q. Up-regulation of fatty acid synthase promoter by hepatitis C virus core protein: genotype-3a core has a stronger effect than genotype-1b core. J Hepatol 2007;46:999–1008.
- Castera L, Hezode C, Roudot-Thoraval F, Lonjon I, Zafrani ES, Pawlotsky JM, et al. Effect of antiviral treatment on evolution of liver steatosis in patients with chronic hepatitis C: indirect evidence of a role of hepatitis C virus genotype 3 in steatosis. Gut 2004;53:420–424.
- Patton HM, Patel K, Behling C, Bylund D, Blatt LM, Vallee M, et al. The impact of steatosis on disease progression and early and sustained treatment response in chronic hepatitis C patients. J Hepatol 2004;40:484–490.
- Lonardo A, Adinolfi LE, Restivo L, Ballestri S, Romagnoli D, Baldelli E, et al. Pathogenesis and significance of hepatitis C virus steatosis: an update on survival strategy of a successful pathogen. World J Gastroenterol 2014;20:7089–7103.
- White DL, Ratziu V, El-Serag HB. Hepatitis C infection and risk of diabetes: a systematic review and meta-analysis. J Hepatol 2008;49:831–844.
- Macias J, Gonzalez J, Tural C, Ortega-Gonzalez E, Pulido F, Rubio R, et al. Prevalence and factors associated with liver steatosis as measured by transient elastography with controlled attenuation parameter in HIV-infected patients. AIDS 2014;28:1279–1287.
- Kohli P, Ganz P, Ma Y, Scherzer R, Hur S, Weigel B, et al. HIV and Hepatitis C-coinfected patients have lower low-density lipoprotein cholesterol despite higher proprotein convertase subtilisin kexin 9 (PCSK9): an apparent “PCSK9-Lipid Paradox”. J Am Heart Assoc 2016;5.
- van der Poorten D, Samer CF, Ramezani-Moghadam M, Coulter S, Kacevska M, Schrijnders D, et al. Hepatic fat loss in advanced nonalcoholic steatohepatitis: are alterations in serum adiponectin the cause? Hepatology 2013;57:2180–2188.
- Mendeni M, Foca E, Gotti D, Ladisa N, Angarano G, Albini L, et al. Evaluation of liver fibrosis: concordance analysis between noninvasive scores (APRI and FIB-4) evolution and predictors in a cohort of HIV-infected patients without hepatitis C and B infection. Clin Infect Dis 2011;52:1164–1173.
- Sebastiani G, Rollet-Kurhajec KC, Pexos C, Gilmore N, Klein MB. Incidence and predictors of hepatic steatosis and fibrosis by serum biomarkers in a large cohort of human immunodeficiency virus mono-infected patients. Open Forum Infect Dis 2015;2:ofv015.
- Kim HN, Nance R, Van Rompaey S, Delaney JC, Crane HM, Cachay ER, et al. Poorly Controlled HIV Infection: An Independent Risk Factor for Liver Fibrosis. J Acquir Immune Defic Syndr 2016;72:437–443.
- European Association for the Study of the Liver/European Association for the Study of Diabetes (EASD)/European Association for the Study of Obesity (EASO). EASL-EASD-EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease. J Hepatol 2016;64:1388–1402.
- Petta S, Wai-Sun Wong V, Camma C, Hiriart JB, Wong GL, Marra F, et al. Improved noninvasive prediction of liver fibrosis by liver stiffness measurement in patients with nonalcoholic fatty liver disease accounting for controlled attenuation parameter values. Hepatology 2017;65:1145–1155.
Имеются противопоказания! Необходима консультация специалиста