Проблема вирусных гепатитов близка к решению. Принятая ВОЗ в 2016 г. «Глобальная стратегия сектора здравоохранения по вирусному гепатиту на 2016–2021 гг.» поставила задачу и определила пути её решения: эффективное использование вакцин против гепатитов А (ГА) и В (ГВ); внедрение современных методов лабораторной диагностики и высокоэффективных методов терапии; широкое внедрение достижений в профилактике и лечении вирусных гепатитов и др. Разработка такой программы стала возможной благодаря полученным новым фундаментальным знаниям о природе вирусных гепатитов, что позволяет решить эту амбициозную задачу. Однако, на наш взгляд, целесообразно прислушаться к высказыванию Бернарда Шоу на обеде в честь Альберта Эйнштейна (Лондон, 28 октября 1930 г.): «Наука не способна решить одну задачу, не поставив при этом еще десять».
Несомненно, реализация программы по контролю за вирусными гепатитами в России, основанная на современных научных знаниях и реалиях эпидемического процесса, позволит решить задачу по контролю над этими заболеваниями. Однако на этом пути возникают новые проблемы. К их числу можно отнести возможность широкого распространения вируса ГА (ВГА) среди отдельных групп населения (вспышка ГА в США в 2017–2018 гг.); межвидовой переход гепатита Е (ГЕ) от животных к человеку; сложности, возникшие при реализации программ массовой вакцинации против ГВ («вакцинный аудит»); историю и особенности циркуляции вируса гепатита D (ВГD) на разных территориях; распространение циркулирующих форм вируса гепатита С (ВГС), обладающих лекарственной резистентностью к препаратам прямого действия (безинтерфероновая терапия).
Получение новых знаний по вышеперечисленным проблемам необходимо для успешной реализации программы по контролю за вирусными гепатитами.
Гепатиты с фекально-оральным механизмом передачи возбудителя
ГА. Его всегда рассматривали как инфекцию, которая в подавляющем большинстве случаев протекает в средне-легкой форме и заканчивается выздоровлением. Прежнее повышенное внимание к этой инфекции определялось высоким уровнем заболеваемости, наличием крупных вспышек с вовлечением сотен и даже тысяч заболевших. Разработка и внедрение в широкую практику здравоохранения вакцины против ГА позволило уже в 90-е годы ХХ века поставить вопрос о глобальном контроле за этой инфекцией. Казалось, еще немного, и будет достигнут успех в этом направлении. Кроме того, создалось мнение, что в изучении ГА не могут быть обнаружены новые фундаментальные данные о возбудителе и эпидемиологии инфекции.
Как известно, ВГА, как и все пикорнавирусы, является безоболочечным патогеном. Однако недавно было открыто, что он выходит из инфицированного гепатоцита покрытым клеточной мембраной, скрывающей его от нейтрализующих антител [1]. Такие покрытые мембраной вирионы являются инфекционными, хотя их мембранная оболочка не содержит вирусных гликопротеинов. По своей сути такие вирионы являются «квази-оболочечными». Во время инфекции «квази-оболочечные» вирионы ВГА циркулируют в крови, тогда как лишенные оболочки вирусы выделяются с фекалиями. Последние крайне устойчивы к нагреванию, низким значениям рН и высушиванию, что обеспечивает распространение вируса. Такой двойной жизненный цикл вируса, покрытого «квази-оболочкой», спрятанного от нейтрализующих антител в инфицированном организме, лишенного оболочки и стабильного во внешней среде, обеспечивает ему уникальные возможности распространения в организме и между восприимчивыми организмами.
Сегодня произошло изменение в характере эпидемического процесса ГА. Общие показатели заболеваемости ГА, прежде всего среди детей и подростков, снизились. Заболеваемость переместилась на старшие возрастные группы, что привело к развитию более тяжелых форм ГА и увеличению числа смертельных случаев. Наличие большой группы лиц, не имеющих антител к ВГА, определило возможность возникновения крупных вспышек инфекции.
В конце 2017 г. и в 2018 г. в некоторых штатах США зарегистрированы крупные вспышки ГА [2], что стало абсолютно неожиданным для общественного здравоохранения страны. Все началось в г. Сан-Диего (Калифорния), где заболели более 500 человек, из которых 19 (3,7%) умерли. Основной контингент заболевших составили бездомные и лица, употребляющие наркотические средства. В дальнейшем подобная ситуация была зарегистрирована в других штатах: Кентукки, Западной Виржинии, Огайо, Индиане и Миссури. Число заболевших составило более 10 000 человек. Предполагают, что интенсивное распространение ВГА среди заболевших происходит при тесном контакте (водный и пищевой пути реализации фекального механизма передачи вируса исключены) на фоне сопутствующих хронических заболеваний печени (ГВ и ГС), иммунодефицитных состояний, употребления алкоголя при отсутствии ранее проведённой вакцинации среди этой группы населения.
Эта ситуация привлекла пристальное внимание специалистов и общества как в США, так и в других странах мира [3]. Основными причинами возникновения данных вспышек являются рост экономического неравенства различных групп населения и неспособность здравоохранения быстро локализовать распространение инфекции.
Возникшая в США ситуация с ГА позволяет сделать ряд выводов, которые важны для развитых стран мира, в том числе и России. Нельзя не согласиться с высказыванием научного сотрудника Университета Джона Хопкинса (Johns Hopkins University, США): «Существует принцип: как только мы обуздали заболевание, мы можем забыть о нем и заняться чем-то еще. Но даже если вы достигли успеха и снизили заболеваемость, многие инфекции могут вернуться» [3].
Исходя из этого, необходима программа по профилактике ГА в России с учетом научных междисциплинарных исследований, направленных на изучение ситуации с ГА и социальных факторов (старение населения, миграционные процессы, бездомные и лица, принимающие наркотики).
ГЕ. В странах с умеренным климатом его часто рассматривают как возникающее или эмергентное заболевание. Этиологическим агентом ГE является вирус гепатита Е (ВГЕ), принадлежащий к роду Orthohepevirus А семейства Hepeviridae [4]. К настоящему времени идентифицировано 8 генотипов ВГЕ, причем генотипы 3, 4, 7 и 8 способны передаваться человеку от животных [5]. Генотипы 3 и 4 встречаются у нескольких видов животных (диких и домашних свиней, кроликов, оленей), при этом считается, что домашние свиньи являются основным резервуаром инфекции в промышленно развитых странах [6]. В настоящее время накоплен массив последовательностей ВГЕ, выделенных от человека и животных на территории РФ, требующий углубленного анализа для понимания эпидемиологии ГЕ. Авторами изучено генетическое разнообразие ВГЕ на территории РФ для установления взаимосвязи между вариантами вируса, выделенными от разных видов хозяев, и реконструирована история заносов ВГЕ на территорию РФ.
Анализ включал 204 последовательностей ВГЕ генотипа 3 (ВГЕ-3), выделенных на территории РФ: 15 последовательностей были выделены от пациентов с острым ГЕ, 171 – от домашних свиней, 2 – из образцов сточных вод свиноферм и 16 – от кроликов. Для всех последовательностей были известны дата и место забора образцов. Также в анализ были включены 10 последовательностей ВГЕ генотипа 4 (ВГЕ-4), из которых 9 были выделены от приматов (яванский макак – Macaca fascicularis) в питомнике ФГБНУ «Научно-исследовательский институт медицинской приматологии» (Сочи) и 1 последовательность – от пациента с ГЕ (импортированный с Корсики случай заболевания [7]). Для всех геноизолятов ВГЕ анализировали фрагмент генома величиной 300 нуклеотидов, соответствующий участку открытой рамки считывания 2 (ОРС-2), кодирующей капсидный белок вируса (координаты фрагмента относительно референсного штамма Burma (GenBank M73218): нуклеотиды 5996–6295). Филогенетические деревья строили с помощью PHYML 3.0, используя модель GTR с коррекцией SPR и тест aBayes. Для филогенетического анализа с временной шкалой по методу MCMC в программе BEAST v.1.8.3 использовали последовательности ВГЕ-3, отличавшиеся друг от друга более чем на 2%. В качестве оптимальной была выбрана модель замен Yang96 с моделью расслабленных некоррелированных логнормальных молекулярных часов. Расчетная скорость накопления замен составила 2,29 x 10-3 замен/сайт/год (95% ДИ 1,83–2,79 x 10-3 ).
Результаты филогенетического анализа продемонстрировали, что подавляющее число последовательностей, выделенных на территории РФ, относится к подгруппе II ВГЕ-3, к которой относится большинство европейских штаммов ВГЕ. По данным филогенетического анализа с временной шкалой, разделение ВГЕ-3 на группы I и II произошло примерно 88 лет назад (95% ДИ 71–106 лет). Большинство российских штаммов ВГЕ-3 образуют группы, характерные для каждого из обследованных регионов (Архангельская, Белгородская, Владимирская, Калининградская, Саратовская, Свердловская области, Хабаровский край) и являющиеся результатом неоднократного заноса вируса как из Европы, так и из Азии. Средний возраст отделения от общего предка для российских региональных кластеров последовательней ВГЕ-3 составляет не менее 25 лет. Последовательности ВГЕ-3, выделенные в одном и том же регионе от людей и от свиней, группируются вместе, что подтверждает зоонозную природу инфекции у человека. Многолетний мониторинг ВГЕ на одной свиноферме продемонстрировал устойчивую циркуляцию одного варианта ВГЕ-3 в течение 5 лет. Последовательности ВГЕ-3, выявленные в сточных водах свиноферм, оказались идентичными последовательностям, выделенным от животных на этих же фермах, и близкими к геноизолятам ВГЕ-3 от заболевших людей в том же регионе РФ. Заражение человека, по-видимому, может происходить не только при алиментарном пути передачи, но и в результате контаминации окружающей среды сточными водами свиноферм. ВГЕ кроликов широко распространен и устойчиво циркулирует на территории РФ [8], однако до настоящего времени в стране не зарегистрировано ни одного случая заражения человека этим вариантом вируса. Последовательности ВГЕ кроликов не группируются с последовательностями ВГЕ-3 от людей и свиней, хотя генетически близки этому генотипу. По расчетным данным, разделение ВГЕ-3 и ВГЕ кроликов произошло в ХIХ веке (95% ДИ 115–184 года назад). Последовательности ВГЕ кроликов, выявленные в одном регионе РФ, демонстрируют значительную степень различия между группами последовательностей [отделение от общего предка более 60 лет назад (95% ДИ 45–78 лет)] при относительно небольшой гетерогенности внутри групп, что свидетельствует о неоднократном завозе разных штаммов ВГЕ кроликов в регион.
Степень гетерогенности и возраст группы последовательностей ВГЕ-4, впервые выделенных от обезьян, составляющий 5,18 лет (95% ДИ 3,47–10,15 лет), свидетельствуют о том, что инфекция у этих животных не является результатом однократного заражения обезьян от одного источника, а отражает циркуляцию вируса среди этих животных. Полученные данные являются первым свидетельством того, что приматы могут выступать в качестве естественного резервуара ВГЕ-4.
Таким образом, современные штаммы ВГЕ-3, выявляемые на территории РФ, являются результатом неоднократных заносов как из Европы, так и из Азии, и их последующей длительной циркуляции среди поголовья свиней в регионах страны. Выделяемые от заболевших людей штаммы ВГЕ-3 не группируются вместе, но имеют общих предков со штаммами, выделенными от свиней, максимум за 20 лет до выделения, что указывает на регулярную передачу вируса от свиней человеку.
Гепатиты с парентеральной передачей возбудителя ГВ
За более чем 50-летний период, прошедший после открытия вируса ГВ (ВГВ), получены фундаментальные знания о вирусе и инфекции, которую он вызывает. Изучены структура вируса, тонкие механизмы репликации, патогенетические основы, разработаны и широко применяются вакцины против ГВ. Однако, несмотря на впечатляющие успехи в борьбе с ГВ, возникли новые проблемы, определяемые как природой заболевания, так и организационными вопросами при реализации программ профилактики. Сегодня очевидно, что при любой инфекции, вызванной ВГВ, даже при наличии всех показателей выздоровления (элиминация ДНК ВГВ, исчезновение HBsAg и появление анти-НВs) в организме человека остаётся ковалентно замкнутая кольцевая ДНК (кзкДНК) ВГВ. Это определяет возможность последующей реактивации ГВ, возникающей в случаях иммунодефицитных состояний (например, при ВИЧ-инфекции или онкологических заболеваниях), под воздействием лекарственной терапии, в том числе при массовом использовании препаратов прямого действия для лечения ГС. Отсутствие доступных методов удаления кзкДНК ВГВ из организма человека не позволяют в ближайшее время надеяться на полную элиминацию ВГВ из человеческой популяции.
Очевидно, что основным, безальтернативным способом полного искоренения ГВ служит массовая вакцинация. В Российской Федерации достигнуты результаты, позволившие резко сократить уровень заболеваемости острым ГВ. По данным Государственного доклада «О состоянии санитарно-гигиенического благополучия населения в Российской Федерации в 2017 году»1, в стране было вакцинировано против ГВ около 3,27 млн человек, в том числе 1,77 млн детей. Общее количество вакцинированного населения с начала иммунизации превышает 100 млн человек. Благодаря проведению этой работы заболеваемость острым ГВ в 2017 г. составила 0,86 на 100 тыс. населения.
В 2018 г. тенденция к снижению показателей заболеваемости ГВ сохранилась.
Общая стратегия программы вакцинопрофилактики направлена на увеличение числа вакцинированных. По нашему мнению, сегодня необходимо направить усилия на улучшение качества проводимой вакцинации, уделив особое внимание своевременной вакцинации новорождённых детей, проведению бустерной вакцинации для сохранения высокого уровня индивидуальной защиты от ГВ (концентрации антител выше 10 МЕ/л), соблюдению холодовой цепи, проведению выборочного серологического мониторинга протективных концентраций анти-НВs после завершения полного курса вакцинации и другим мероприятиям, ассоциированным с проведением вакцинации. Для этого необходима разработка так называемой системы «вакцинного аудита».
О необходимости проведения такой работы могут свидетельствовать данные, полученные нами ранее. Были проанализированы результаты выявления протективных уровней поствакцинальных анти-HBs среди взрослого населения четырех регионов страны (Республики Тыва, Хабаровского края, Саратовской и Свердловской областей), получивших полный курс вакцинации препаратом одного и того же производителя. Частота обнаружения анти-HBs в защитном титре (более 10 МЕ/л) колебалась от 67,2 до 88,1% [9].
ГD. В Российской Федерации изучению ГD уделяется предельно мало внимания. Для этого есть ряд причин: отсутствие официальной регистрации заболевания, неравномерная циркуляция вируса на территории страны (ВГD относительно редко встречается в Европейской части РФ, где сосредоточено большинство научных и клинических центров). Данные о современной эпидемиологии ВГD, генетическом разнообразии, времени циркуляции вируса и истории его распространения на отдельных территориях, молекулярной эпидемиологии в России ограничены. Авторы провели анализ современного эпидемиологического профиля ГD и генетического разнообразия ВГD в эндемичных регионах РФ, а также реконструировали историю распространения ВГD на этих территориях.
В исследование были включены образцы сыворотки крови, полученные от условно здорового населения Республики Тыва (п = 1154) от новорожденных до лиц старше 60 лет. Все обследованные были разделены по возрастным группам: до 1 года, 1 год –7 лет, 8–14 лет, 15–19 лет, 20–29 лет, 30–39 лет, 40–49 лет, 50–59 лет и 60 лет и старше; каждая группа включала около 100 человек. Серологические маркеры инфицирования ВГВ (HBsAg, анти-HBc) и ВГD (анти-ВГD) определяли методом иммуноферментного анализа с использованием тест-систем «ДС-ИФА-HBsAg-0,01», «ДС-ИФА-HBsAg-0,01-подтверждающая» (для подтверждения в реакции нейтрализации позитивных результатов выявления HBsAg), «ДС-ИФА-анти-HBс», «ДС-ИФА-анти-HDV» (НПО «Диагностические системы», Нижний Новгород) в соответствии с инструкцией производителя. Также были исследованы образцы сыворотки крови 139 больных хроническими ГВ и ГD, проживающих в Республике Тыва (24 образца – в 2009 г., 15 – в 2014 г. и 91 – в 2017 г.) и Республике Саха (Якутия) (9 образцов – в 2018 г.), положительных по РНК ВГD. Для каждого изолята ВГD амплифицировали и секвенировали фрагмент гена R0 (400 нт), для 12 изолятов из Республики Тыва и 9 изолятов из Республики Саха (Якутия) получали полногеномную последовательность методом амплификации двух перекрывающихся участков вирусного генома 950 и 1100 нт соответственно. Полученные последовательности выравнивали с помощью программы Mega 7.0, филогенетический анализ с временной шкалой выполняли с помощью байесовского алгоритма правдоподобия, реализованного в программе BEASTv1.8.4.
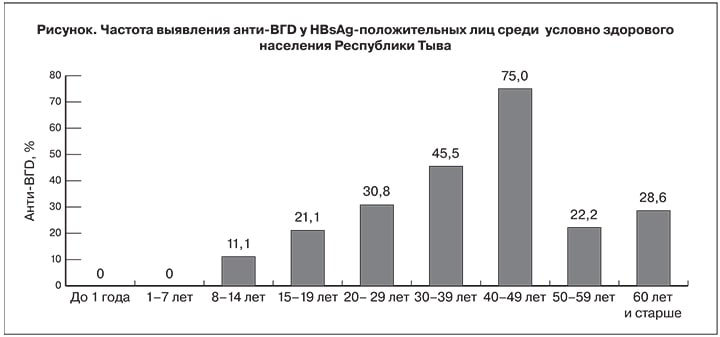
При обследовании 1154 представителей условно здорового населения HBsAg определен в 95 (8,2%) случаях, анти-HBc – в 531 (46,2%) и анти-ВГD – в 27 (2,3%). Наибольшая частота выявления HBsAg (17,6%) отмечена в группе подростков 15–19 лет, наименьшая (2,3%) – в группе младенцев до 1 года; максимальная частота выявления анти-НВс (81,3%) – в группе 60 лет и старше, минимальная (3,7%) – у детей от 1 года до 7 лет. Распространенность анти-ВГD среди HBsAg-положительных лиц составила в среднем 28,4% (у 27 из 95 обследованных), достигая пика (75%) в возрастной группе 40–49 лет (см. рисунок). Среди детей до 7 лет, рожденных после внедрения массовой вакцинации новорожденных против ГВ, не было отмечено ни одного случая выявления анти-ВГD. Эти данные являются первым свидетельством предотвращения распространения ВГD на популяционном уровне в эндемичном регионе в результате массовой вакцинация против ГВ.
Результаты филогенетического анализа продемонстрировали, что все выделенные в Республике Тыва изоляты ВГD относятся к генотипу 1 и образуют несколько кластеров, группируясь с последовательностями из РФ, Турции, Китая и Монголии. Для 12 представителей четырех основных тывинских кластеров ВГD и 9 штаммов из Республики Саха (Якутия) были получены полногеномные последовательности (GenBank MH791027-MH791030). Из 9 последовательностей ВГD из Якутии 4 относились к генотипу 1, 5 – к генотипу 2. Все якутские последовательности генотипа 2 образуют отдельный кластер, значительно отличающийся от остальных штаммов этого генотипа.
Филогенетический анализ с временной шкалой продемонстрировал, что отделение современных тывинских штаммов ВГD от общего предка произошло в 60-е годы ХХ века (95% ДИ 40–66 лет назад), в то время как возраст современных штаммов ВГВ, циркулирующих в Тыве, составляет несколько сотен лет. Предположительно, распространение ВГD в середине прошлого века в этом регионе, где изначально был широко распространен ВГВ, было связано с началом массовых медицинских парентеральных вмешательств.
Анализ последовательностей ВГD из семейных очагов инфекции показал наличие вариантов вируса как близкородственных, так и значительно различающихся между собой, что указывает на гетерогенные источники инфицирования.
Таким образом, массовая вакцинация против ГВ предотвращает распространение ВГD даже в эндемичном регионе и является единственным действенным инструментом управления этой инфекцией. На территории Якутии встречается ВГD генотипов 1 и 2, тогда как в Тыве циркулирует вирус только генотипа 1. Его широкое распространение в регионе произошло в середине ХХ века, в отличие от ВГВ, распространение которого на этой территории имеет значительно более длительную историю. Полученные данные могут послужить материалом для дальнейших исследований по изучению широкого распространения ВГD на отдельных территориях Российской Федерации.
ГС. Одним из важнейших успехов последних лет в борьбе с вирусными гепатитами является разработка и внедрение в клиническую практику безинтерфероновых схем лечения хронического ГС (ХГС). Применение препаратов прямого противовирусного действия (ПППД) – ингибиторов вирусных белков протеазы NS3, белка NS5A и полимеразы NS5B позволяет достигать устойчивого вирусологического ответа (УВО) более чем у 95% пациентов [10]. Несмотря на относительно небольшой (не более 5 лет) мировой опыт применения ПППД, уже накоплены данные о влиянии полиморфизмов в геноме ВГС на эффективность терапии с применением ПППД. Неудачи терапии, по-видимому, обусловлены сочетанием нескольких неблагоприятных факторов, одним из которых является феномен лекарственной резистентности ВГС. Анализ Европейской базы данных по резистентности к ПППД продемонстрировал, что в 83% случаев отсутствия УВО в участках генома вируса, кодирующих белки мишени для ПППД, обнаруживали 1 или несколько аминокислотных замен, ассоциированных с лекарственной резистентностью (Resistance Associated Substitution – RAS) [11]. Наибольшее клиническое значение имеют RAS ВГС, связанные с резистентностью к ингибиторам белка NS5А (даклатасвир, ледипасвир, омбитасвир, пибрентасвир и элбасвир), являющимся препаратами первой линии [12]. По-видимому, это связано с тем, что белок NS5А не является ферментом, в отличие от других мишеней ПППД – белков ВГС NS3 и NS5B, и, вероятно, имеет более высокую степень изменчивости при сохранении функции белка и, соответственно, фитнесса вируса. Для RAS NS5А возможно длительное сохранение в квазивиде ВГС после прекращения неудачной терапии [13], и описаны случаи передачи таких вариантов ВГС в группах риска [14].
Данные о распространенности RAS ВГС в России носят отрывочный характер. Учитывая небольшой охват терапией ПППД в России в настоящее время (не более 1,7% от числа инфицированных [15]), полученные данные о распространенности RAS могут послужить «нулевой точкой», которая в дальнейшем послужит для оценки влияния массового применения этих препаратов на распространение резистентных вариантов.
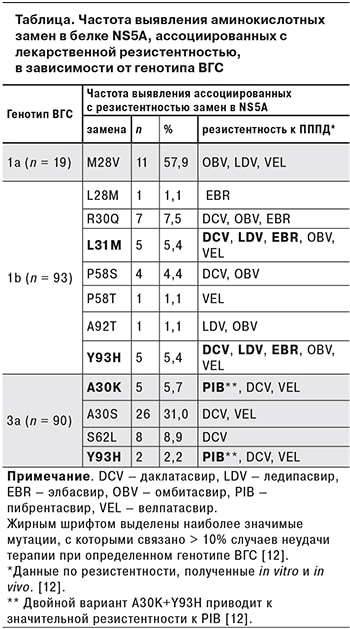
Авторами проведен анализ 202 последовательностей NS5А ВГС, выделенных в 2008–2014 гг. в Москве от пациентов из групп повышенного риска инфицирования (инъекционные наркоманы, n = 67) и лиц без установленных факторов риска (n = 135). В исследование были включены последовательности наиболее распространенных в РФ генотипов ВГС: 1b (n = 93), 3а (n = 90) и 1а (n = 19). Процентное соотношение последовательностей ВГС генотипов 1а, 1b и 3а в исследованной выборке составило 9,4, 46,0 и 44,6% соответственно, что соответствует распределению этих генотипов на территории нашей стораны [16].
Фрагмент NS5A величиной 1292 нт для генотипа 1 и 1296 нт – для генотипа 3 амплифицировали с генотип-специфичными праймерами и определяли его нуклеотидную последовательность на автоматическом секвенаторе 3500 Genetic Analyzer (ABI, Foster City, США) с использованием набора BigDye Terminator v 3.1 Cycle Sequencing Kit (Applied Biosystems, США) [17]. Для выравнивания последовательностей и определения порядка аминокислотных позиций использовали референсный штамм H77 субтипа ВГС 1а (GenBank AF011753). Анализ всех нуклеотидных и предсказанных аминокислотных последовательностей ВГС выполняли с помощью программного обеспечения MEGA 7.0.18. Перечень клинически значимых RAS NS5A формировали на основании последних рекомендаций Европейской ассоциации по изучению печени (EASL) [10] и обзора данных литературы [12, 18, 19]. Оценку частоты встречаемости в аа позициях NS5а 28, 29, 30, 31, 32, 58, 62, 92 и 93 проводили с помощью программного обеспечения Microsoft Office Excel.
Доля штаммов, несущих в NS5A те или иные полиморфизмы, связанные с лекарственной устойчивостью, составила 30,2% (61 из 202), при этом доля таких штаммов составила 57,9% (11из 19) для генотипа 1а, 22,6% (21 из 93) – для генотипа 1b и 43,3% (39 из 90) – для генотипа 3а. Показатели частоты выявления каждого полиморфизма в NS5A ВГС приведены в таблице.
Среди штаммов генотипа 1а были выявлен один полиморфизм M28V, связанный с устойчивостью штаммов ВГС 1а к омбитасвиру, ледипасвиру и велпатасвиру; доля несущих M28V последовательностей составила 57,9%. В то же время замены Q30R, L31M и Y93H, связанные с устойчивостью практически ко всем ингибиторам NS5A (даклатасвиру, ледипавиру, омбитасвиру, велпатасвиру и элбасвиру) не были выявлены ни в одной последовательности ВГС 1а. Поскольку в последовательностях NS5A ВГС генотипа 1а частота выявления полиморфизмов, связанных с лекарственной устойчивостью, оказалась неожиданно высокой, и наблюдался очень характерный профиль этих мутаций, был проведен филогенетический анализ последовательностей этого генотипа для установления родственных связей между ними. Оказалось, что все последовательности NS5A российских штаммов ВГС генотипа 1а, за исключением двух, формируют единую монофилетическую группу, наиболее близкую к штаммам из США и, по-видимому, являются результатом однократного заноса ВГС генотипа 1а на территорию России. Идентичные результаты были получены при анализе последовательностей участка генома, кодирующего белок core. По-видимому, широкая распространенность аа замен в NS5A в российских последовательностях ВГС генотипа 1а связана с «эффектом основателя», то есть несущий эту замену штамм, будучи импортированным в Россию, послужил предком для большинства российских штаммов этого генотипа.
Среди последовательностей генотипа 1b были выявлены связанные с устойчивостью к большинству ингибиторов NS5A замены L31M и Y93H, каждая с частотой 5,4%, а также менее значимые с клинической точки зрения замены L28M, R30Q, P58S/T и A92T.
Замена A30S, связанная с устойчивостью к даклатасвиру и велпатасвиру и характерная исключительно для штаммов генотипа 3а, была выявлена среди 31% последовательностей этого генотипа. Другой вариант в этой позиции, А30К, тоже связанный с устойчивостью к даклатасвиру и велпатасвиру, был выявлен в 5,7% случаев. Полиморфизм Y93H, характерный для разных генотипов ВГС, был представлен в 2,2% последовательностей ВГС 3а.
Большинство штаммов ВГС содержали только одну замену в NS5A, однако 5 последовательностей несли одновременно по 2 замены: R30Q + Y93H, P58T + Y93H и A92T + Y93H при генотипе 1b; A30K + S62L и S62L + Y93H при генотипе 3a (номера GenBank MH373296, MH373314, MH373334, MH432639 и MH432554 соответственно).
Сложно оценить клиническую значимость широкой распространенностью RAS NS5A среди российских пациентов, инфицированных ВГС генотипа 1a, и угрозу, которую они представляют для применения ингибиторов NS5A. Эти препараты применяются в сочетании с ингибиторами NS3 или NS5B, что должно обеспечивать успех противовирусной терапии, несмотря на наличие RAS в NS5A. В настоящее время тестирование на наличие RAS в NS5A до начала терапии рекомендовано только в следующих случаях: для пациентов с ВГС генотипа 1a (независимо от опыта терапии и степени фиброза) при назначении схемы элбасвир/гразопревир; для ранее получавших терапию пациентов с ВГС генотипа 1a при назначении схемы ледипасвир/софосбувир; для ранее получавших терапию пациентов (а также не получавших терапию пациентов с циррозом) с ВГС генотипа 3a при назначении схемы софосбувир/велпатасвир или даклатасвир/софосбувир [20]. Широкая распространенность полиморфизма M28V среди российских последовательностей ВГС генотипа 1a указывает на целесообразность тестирования на наличие этого варианта отечественных пациентов, инфицированных ВГС генотипа 1а, перед назначением схем терапии, включающих ингибиторы NS5A. Умеренная распространенность наиболее клинически значимых RAS среди российских штаммов ВГС генотипов 1b и 3a указывает на отсутствие в настоящее время необходимости тестировать на наличие генетических детерминант резистентности перед началом терапии пациентов, инфицированных этими генотипами.
Таким образом, полученные данные о распространенности полиморфизмов в NS5A ВГС, связанных с лекарственной устойчивостью, составляют «нулевую точку» в изучении распространенности данных мутаций, поскольку получены до внедрения в широкую практику терапии ХГС с применением ПППД. Следующим шагом является определение распространенности данных мутаций через несколько лет после широкого применения ПППД. Эти исследования позволят оценить, насколько определенные замены в NS5А дают преимущество ВГС в сохранении и распространении вируса в условиях проведения противовирусной терапии.
Заключение
Анализируя современную ситуацию с вирусными гепатитами, можно сделать оптимистический прогноз. «Глобальная стратегия сектора здравоохранения по вирусному гепатиту на 2016–2021 гг.», принятая ВОЗ, даёт чёткие ориентиры для ее выполнения. Разработка аналогичной программы для Российской Федерации – задача сегодняшнего дня. В 2018 г. нами был предложен «Проект программы по контролю и ликвидации вирусных гепатитов как проблемы общественного здравоохранения» [21, 22]. Предлагается первоначально провести работу в трех регионах страны, что позволит получить данные, отвечающие реалиям сегодняшнего дня, с последующим учетом установленных фактов в общероссийской программе. Несомненно, при этом будут учтены проблемы, упомянутые в настоящей статье.
Список литературы
- Lemon S.M., Ott J.J., van Damme P., Shouval D. Type A viral hepatitis: A summary and update on the molecular virology, epidemiology, pathogenesis and prevention. J. Hepatol . 2017; 68 (1): 167–84.
- Foster M., Ramachandran S., Myatt K., Donovan D., Bohm S., Fiedler J. et al. Hepatitis A Virus Outbreaks Associated with Drug Use and Homelessness – California, Kentucky, Michigan and Utah, 2017. MMWR Morb Mortal Wkly Rep. 2018; 67(43): 1208–10. DOI:10.15585/mmwr.mm6743a3
- Паршли Л., Мойер М.У. Новые болезни нового мира. В мире науки 2018; (7): 54–69.
- Smith D.B., Simmonds Р., Jameel S. Consensus proposals for classification of the family Hepeviridae. J. Gen. Virol. 2014; 95: 2223–32.
- Woo P.C.Y., Lau S.K.P., Teng L.L., Cao K.Y., Wernery U., Schountz, T. et al. New Hepatitis E Virus Genotype in Bactrian Camels, Xinjiang, China, 2013. Emerg. Infect. Dis. 2016; 22(12): 2219–21.
- Teshale E.H., Hu D.J., Holmberg S.D. The two faces of hepatitis E virus. Clin. Infect. Dis. 2010; 51: 328–34.
- Михайлов М.И., Малинникова Е.Ю., Кюрегян К.К., Исаева О.В. Случай завоза вируса гепатита Е 4 генотипа в Россию. Журнал микробиологии, эпидемиологии и иммунобиологии 2016; (3): 64–9.
- Mохаммед А.М.Е., Потемкин И.А., Карлсен А.А., Исаева О.В., Кюрегян К.К., Козлов В.Г., Жаворонок С.В., Михайлов М.И. Циркуляция вируса гепатита Е кроликов на территориях с разной степенью эндемичности по гепатиту Е. Современные проблемы науки и образования 2015; (2). https://science-education.ru/ru/article/ view?id=18395
- Кожанова Т.В., Клушкина В.В., Гордейчук И.В., Кюрегян К.К., Михайлов М.И. Оценка иммунологической эффективности массовой вакцинации против гепатита В. Труды Института полиомиелита и вирусных энцефалитов имени М.П. Чумакова РАМН. Медицинская вирусология 2014; 28(1): 16–25.
- European Association for the Study of the Liver. EASL Recommendations on Treatment of Hepatitis C 2018. J. Hepatol. 2018. pii. S0168-8278(18)31968-8. DOI: 10.1016/j.jhep.2018.03.026.
- Vermehren J., Susser S., Dietz.J., von Hahn T., Petersen J., Hinrichsen H. Retreatment of patients who failed DAA-combination therapies: real-world experience from a large hepatitis C resistance database. J. Hepatol. 2016; 64 (2): S188. DOI: https://doi.org/10.1016/S0168-8278(16)00128-8.
- Wyles D.L. Resistance to DAAs: When to Look and When It Matters. Curr. HIV/AIDS Rep. 2017; 14(6): 229–37. DOI: 10.1007/s11904-017-0369-5.
- Wyles D., Mangia A., Cheng W., Shafran S., Schwabe C., Ouyang W. Long-term persistence of HCV NS5A resistance associated substitutions after treatment with the HCV NS5A inhibitor, ledipasvir, without sofosbuvir. Antivir. Ther. 2017; 23(3):229-238. DOI: 10.3851/IMP3181.
- Abravanel F., Métivier S., Chauveau M., Péron J.-M., Izopet J. et al. Transmission of HCV NS5A Inhibitor–Resistant Variants Among HIV-Infected Men Who Have Sex With Men. Clin. Infect. Dis. 2016; 63(9): 1271–2.
- Никитин И.Г., Попович Л.Д., Потапчик Е.Г. Экономическое бремя хронического гепатита С в России. Эпидемиол. инфекц. болезни. Актуал. вопр. 2015; (6): 9–13.
- Исаева О.В., Кичатова В.С., Карлсен А.А., Солонин С.А., Дмитриев П.Н., Кюрегян К.К., Михайлов М.И. Многолетняя динамика распространения генотипов вируса гепатита С в Московском регионе. Журнал микробиологии, эпидемиологии и иммунобиологии 2016; (4): 35–42.
- Кичатова В.С., Карлсен А.А., Исаева О.В., Солонин С.А., Малинникова Е.Ю., Кюрегян К.К., Михайлов М.И. Лекарственно-резистентные варианты ВГС субитпа 1b, циркулирующие на территории Российской Федерации: анализ аминокислотных мутаций в белках NS5a и core. Журнал инфектологии 2018; 10(4): 30–6. DOI: 10.22625/2072-6732-2018-10-4-30-36.
- Jacobson I.M., Asante-Appiah E., Wong P., Black T., Howe A.Y.M. Prevalence and impact of baseline NS5A resistance associated variants (RAVs) on the efficacy of elbasvir/grazoprevir (EBR/GZR) against GT1a infection. Hepatol. Baltim. Md. 2015; 62: 1393A–4A.
- Zeuzem S., Mizokami M., Pianko S., Mangia A, Han KH, Martin R. et al. NS5A resistance-associated substitutions in patients with genotype 1 hepatitis C virus: Prevalence and effect on treatment outcome. J. Hepatol. 2017; 66(5): 910–8.
- Recommendations for Testing, Managing, and Treating Hepatitis C/HCV Guidance. https://hcvguidelines.org/.
- Михайлов М.И., Ющук Н.Д., Проект программы по контролю и ликвидации вирусных гепатитов как проблемы общественного здравоохранения. Медицинская газета 2018; (11): 10–1.
- Михайлов М.И., Ющук Н.Д., Малинникова Е.Ю., Кюрегян К.К., Исаева О.В., Знойко О.О., Климова Е.А. Проект программы по контролю и ликвидации вирусных гепатитов как проблемы общественного здоровья в Российской Федерации. Инфекционные болезни: новости, мнения, обучение 2018; 7(2): 52–8.
Авторы
Михайлов М.И., Кюрегян К.К., Малинникова Е.Ю., Исаева О.В., Карлсен А.А., Потемкин И.А., Кичатова В.С., Аль-Шараби Шукри А.С., Догадов Д.И., Корзая Л.И., Игнатьева М.Е., Поляков А.Д.
Имеются противопоказания! Необходима консультация специалиста