Эффективность нового поколения методов лечения гепатита С — противовирусных средств прямого действия (ПППД), зависит от генотипа, подтипа и связанных с резистентностью замен, присутствующих у отдельных пациентов. Целью данного исследования была оценка массивной платформы секвенирования для анализа генотипов и подтипов вируса гепатита С (ВГС) с целью оптимизации терапии.
Всего было проанализировано 84 пациента с гепатитом С. Методология рутинного генотипирования ВГС, используемая в лечебном учреждении (Versant HCV Assay, LiPA), была сопоставлена с платформой глубокого секвенирования (454/GS-Junior и Illumina MiSeq).
Пациенты, посещающие амбулаторную клинику Университетской больницы Вальме (январь 2015 — май 2016) с хронической активной инфекцией ВГС, были отобраны и классифицированы по генотипу, определенному с помощью анализатора ВГС Genotype 2.0 (LiPA ВГС V.2.0). Все данные пациентов были закодированы для сохранения анонимности. Для определения вирусной нагрузки и генотипов использовали образцы сыворотки крови, полученные от пациентов до лечения ВГС. Средняя вирусная нагрузка составила 6,89 × 10^6 ± 7,02 × 10^5.
Всего было обследовано 84 пациента: 51 мужчина и 33 женщины. Их средний возраст на исходном уровне составил 53,8 ± 8,3 года. Тридцать пять пациентов (42%) получали тройную терапию ВГС (пегилированный интерферон + рибавирин + телапревир / боцепревир). Сорок девять пациентов (58%) получили без-интерфероновую терапию, основанную на софосбувире. Семнадцать (14%) пациентов, не ответили на противовирусную терапию: 15 не отреагировали на тройную схему ИНФ+РБВ+ТЕЛ, и два не ответили на терапию софосбувиром.
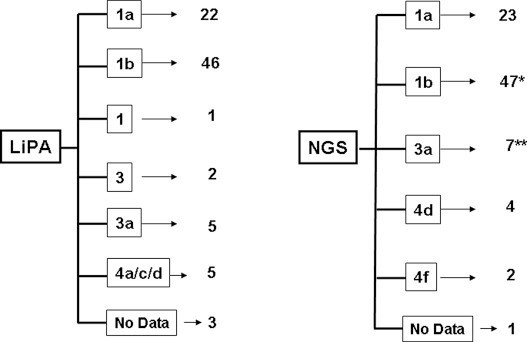
Распределение генотипов ВГС для исследования пациентов в зависимости от используемого метода генотипирования — анализатор (LiPA) и глубокого секвенирования представлены на рисунке 1 (см. ниже). Основное различие выявлено у больных, инфицированных генотипами ВГС 3 и 4, которые не могли быть классифицированы по подтипам обычным методом. Для еще двух образцов подтип не удалось определить с помощью LiPA. Эта проблема была решена при использовании метода глубокого секвенирования.
Благодаря методу глубокого секвенирования удалось выявить пациентов с микст-инфекцией ВГС — шесть из 84 пациентов (7%) были инфицированы более чем одним подтипом одновременно. Четыре из них (4/6, 67%) были инфицированы подтипами 1a и 1b, а два других (2/6, 33%) — подтипами 1b и 3a.
|
Код пациента |
Вирусная нагрузка |
Генотип |
|
7217 |
548 000 |
1a (2%) + 1b (98%)a |
|
72-69060 |
656 000 |
1a (1%) + 1b (99%) |
|
62205 |
3 670 000 |
1a (1%) + 1b (99%) |
|
696561 |
2 900 000 |
1a (1%) + 3a (99%)b |
|
707400 |
583 000 |
1b (99%) + 3a (1%) |
|
331235 |
6 892 395 |
1a (3%) + 1b (97%) |
a — Этот пациент не ответил на лечение софосбувир + ледипасвир.
b — Этот пациент не ответил на лечение софосбувир + даклатасвир.
Интересно, что два из шести пациентов со смешанной инфекцией (33%) имели опыт неудачного лечения препаратами прямого противовирусного действия. Эти два пациента были подвергнуты тщательному анализу, который показал отсутствие каких-либо мутаций, указывающих на потенциальную устойчивость к проведенной терапии. Смешанные инфекции зачастую очень сложно обнаружить, используя стандартные методики. Глубокое секвенирование — единственный доступный метод, который позволяет их идентифицировать.
Некоторые ППВД используемые для терапии ВГС имеют эффективность только по отношению к конкретному генотипу. Потенциальный исход лечения при смешанных инфекциях пока еще не рассмотрен в клинических руководствах. Это, по всей видимости, связано с тем, что коммерчески доступные методы генотипирования способны идентифицировать только доминирующий генотип.
В этом исследовании было продемонстрировано, что обычным методом не удалось точно выявить подтип в семи случаях из 84 (8.5%). Это является значительной проблемой с клинической точки зрения, поскольку данная информация полезна для назначения адекватной терапии, ведения пациентов и эпидемиологических исследований ВГС (Tong et al., 2015; Nieto-Aponte et al. 2017,).
Дополнительным преимуществом методов глубокого секвенирования является возможность обнаружения смешанных инфекций. В этом исследовании шесть смешанных инфекций были обнаружены в 84 образцах (7%). Другие исследования обнаружили смешанные инфекции ВГС в количестве от 5% до 25,3% (Pham et al., 2010; Thomson et al., 2011). Кроме того, сложности с лечением узконаправленными препаратами прямого противовирусного действия в случае с пациентами, имеющими смешанные инфекции, могут быть связаны с возникновением «переключения генотипа», в результате чего ранее не выявленный лекарственно-устойчивый вариант начинает заменять собой успешно устраненный основной вариант (Quer et al., 2016).
В настоящем исследовании большинство пациентов получали тройную терапию ИНФ+РБВ+ТЕЛ. У двух пациентов, из тех у которых были выявлены смешанные инфекции, терапия с помощью СОФ+ЛЕД и СОФ+ДАК была неудачной, при этом не было найдено никаких зависимостей, связанных с резистентностью по отношению к препаратам прямого противовирусного действия. Наличие различных генотипов напрямую влияет на достижение устойчивого ответа на лечение и влияния на тяжесть заболевания (EASL, 2015). Совсем недавно было установлено, что NS5A-резистентные замены у пациентов с генотипом 1a отрицательно влияют на результат лечения (Zeuzem et al., 2017). В настоящее время ведется разработка стандартного протокола глубокого секвенирования для обнаружения мутаций, вызывающих устойчивость к ингибиторам NS3, NS5A и NS5B.
В заключение, анализ на основе глубокого секвенирования гораздо надежнее и полезнее, чем традиционные тестовые системы, используемые в настоящее время в клинической практике. Тем не менее, методы глубокого секвенирования по-прежнему дороги по сравнению с обычными методами. Точное определение вирусных генотипов и подтипов позволит обеспечить оптимальное ведение пациентов и подбор наиболее эффективной терапии для каждого конкретного случая. Кроме того, обнаружение смешанных инфекций может объяснить неудачу предыдущей терапии.
Источник:
International Journal of Infectious Diseases Volume 67, February 2018 , Pages 114-117
http://www.ijidonline.com/article/S1201-9712(17)30328-4/abstract
Коллектив авторов:
José A. del Campoab, Manuel Parra-Sánchezc, Blanca Figueruelaa, Silvia García-Reyc, Josep Querbd, Josep Gregoribde, Samuel Bernalc, Lourdes Grandea, José C. Palomaresc, Manuel Romero-Gómezbf.
a — UCM Digestive Diseases, Valme University Hospital, Seville, Spain.
b — Centro de Investigación Biomédica en Red (CIBER) de Enfermedades Hepáticas y Digestivas (CIBERehd) del Instituto de Salud Carlos III, Madrid, Spain.
c — UCM Infectious Diseases and Microbiology, Valme University Hospital, Seville, Spain.
d — Liver Unit, Liver Disease Laboratory – Viral Hepatitis, Internal Medicine Department, Vall d’Hebron Institut Recerca (VHIR-HUVH), Universitat Autonoma Barcelona, Barcelona, Spain.
e — Roche Diagnostics SL, Sant Cugat del Vallès, Barcelona, Spain.
f — Hospital Universitario Virgen del Rocío, Instituto de Investigación Biomédica de Sevilla (IBiS), Seville, Spain.
Похожие статьи:
- Тест-систему по генотипированию разработали в Ульяновске
Ульяновская компания «ТестГен» разработала прототип тест-системы для генотипирования вируса гепатита С, обеспечивающий выявление генотипов 1a,…
- Какие пути передачи вируса гепатита С существуют
Вирус гепатита С передается через кровь зараженного человека неинфицированному. В наши дни большинство случаев (50%)…
- Лечение гепатита С нельзя откладывать
Новое исследование показало высокие показатели излечения от гепатита С среди употребляющих наркотики и алкоголь. Подробнее…