Введение
Хронический вирусный гепатит С (ВГС) является одним из основных заболеваний печени во всем мире. Распространеннее антител к ВГС на уровне глобальной популяции по примерным оценкам составляет около 1,6%, что соответствует 115 миллионов человек, при этом среди 1,1% (85 миллионов человек) выявляется вирусная РНК. Заболевания ассоциированные с ВГС, включая развитие декомпенсированного цирроза печени и гепатоцеллюлярной карциномы, являются основными показаниями для проведения трансплантации печени (ТП). На сегодняшний день в Бразилии более 70% соответсвующих операций среди взрослых пациентов связаны с негативными последствиями вызванными ВГС. В тоже время, рецидив ВГС после ТП достаточно распространен и часто связан с быстрым течением и наступлением печеночно-клеточной недостаточности. По объективным оценкам, прогрессирование цирроза возникает среди 30% реципиентов в течение 5-летнего периода после ТП, что существенно увеличивает риск функционирования трансплантата и снижает общую выживаемость данной группы пациентов. В тоже время своевременное лечение рецидива ВГС на фоне ТП может обеспечить функционирование трансплантата и дальнейшее выживание пациента.
В последнее время широкое использование новых противовирусных препаратов прямого действия (ПППД), таких как софосбувир (СОФ), симепревир (СИМ) и даклатасвир (ДАК), привело к высоким показателям достижения излечения, включая группу реципиентов ТП, критерием которого является получение устойчивого вирусологического ответа (УВО). Несмотря на небольшую выборку пациентов, в большинстве исследований эффективности лечения рецидива ВГС после ТП, клинические испытания последовательно показывают частоту УВО около 90%. Более того, новые ПППД существенно безопаснее, чем схемы на основе интерферона (ИНФ) используемые ранее. Насколько нам известно, в Бразилии до настоящего времени не было опубликовано ни одного исследования по лечению рецидива вирусного гепатита С среди пациентов после проведенной трансплантации печени.
Целью данного исследования является оценка эффективности и безопасности лечения вышеобозначенной группы пациентов в условиях университетской больницы при помощи терапии основанной на софосбувире.
Материалы и методы
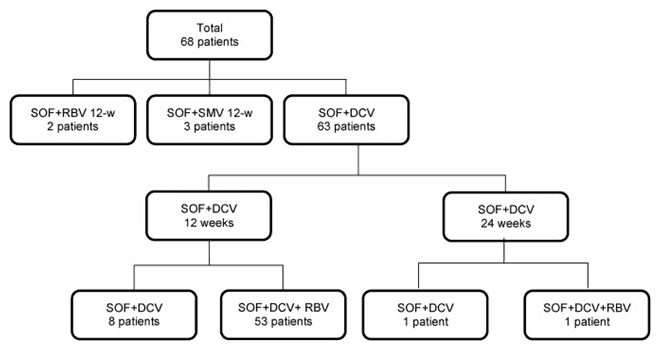
Это ретроспективное исследование включало 68 взрослых пациентов с рецидивом ВГС после ТП, которые получали лечение с использованием различных схем на основе СОФ в период с марта 2015 года по декабрь 2016 года. Выбор схем лечения, их длительности и применения рибавирина (РБВ) был сделан лечащим врачом. Эффективность противовирусной терапии оценивали на основе достижения устойчивого вирусного ответа, полученного через 12 недель после окончания лечения (УВО12).
Результаты
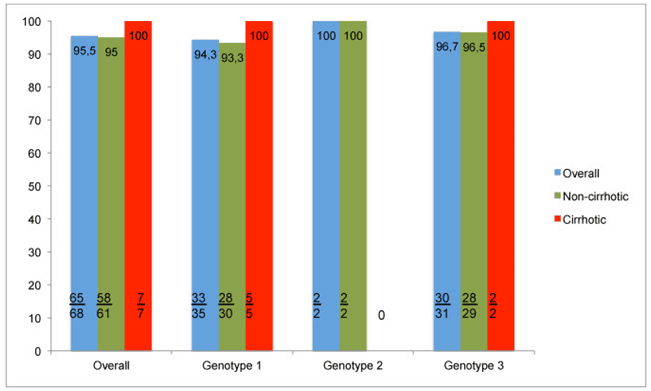
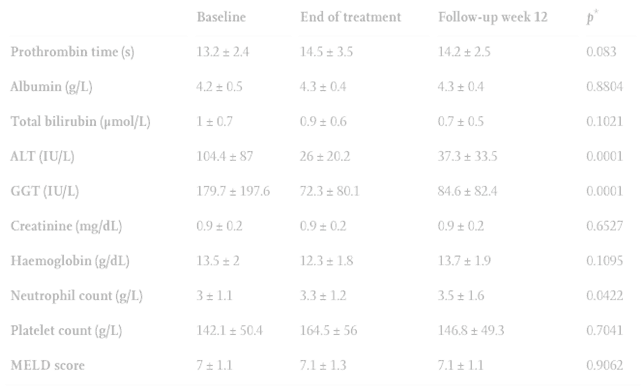
Наиболее часто встречаемыми генотипами ВГС были 1 и 3 (n = 35, 51,4% и n = 31, 45,6% соответственно). 22 пациента были не имели тяжелого фиброза (32,3%), а у 7 был цирроз печени (10,2%). Наиболее часто используемой схемой был СОФ + ДАК (n = 63, 92,6%). Для большинства пациентов использовали РБВ (n = 56, 82,3%) с терапией длительностью 12 недель (n = 66, 97%). Общее достижение УВО12 составило 95,5% (65/68 пациентов). У трех пациентов наблюдался вирусологический прорыв. При этом, все из них не имели цирроза печени, а по данным пункционной биопсии были выявлены стадии фиброза F2 у одного пациента и F0 у двух других. Следующие три пациента продемонстрировали высокий уровень побочных эффектов, однако никто из них преждевременно не прекратил лечение. Анемия связанная с РБВ встречалась наиболее часто (n = 34, 50%). У четырех пациентов наблюдалась сильная реакция отторжения трансплантата после элиминации ВГС, при стабильном уровне иммуносупрессии.
Обсуждение
ПППД произвели революцию в лечении рецидива гепатита С после проведения ТП, позволив не только начинать терапию в ранний период обнаружения рецидива с высокой вероятностью достижения УВО12, но и характеризуются низким уровнем лекарственного взаимодействия с хорошей переносимостью. Кроме того, элиминация ВГС предотвращает развитие в трансплантате терминальной стадии печеночно-клеточной недостаточности. Большинство исследований также отмечают низкую частоту возникновения побочных эффектов среди данной группы пациентов, в том числе на фоне имунносупрессии после проведенной трансплантации печени.
Это исследование проведенное в условиях государственной университетской больницы на юге Бразилии, впервые в Латинской Америке описывает опыт лечения рецидива ВГС после проведенной трансплантации печени различными схемами с использованием ПППД. В данном исследовании мы использовали различные схемы на основе софосбувира, независимо от применения РБВ, в течение 12 или 24 недель. Наибольшая доля пациентов имела 1 и 3 генотипы ВГС. Около 10% пациентов имели выраженный цирроз печени. В данное исследование не был включен ни один пациент после трансплантации печени связанной с ГЦК. Наиболее широко используемой схемой лечения была СОФ + ДАК + РБВ длительностью 12 недель. Для незначительной части пациентов были использованы схемы СОФ + СИМ или СОФ + РБВ, поэтому сравнение эффективности различных вариантов лечения не проводилось. Общий уровень достижения УВО12 составил 95,5% (65/68 пациентов). У трех пациентов наблюдался вирусологический прорыв. Удивительно, но среди них не было ни одного случая цирроза (два пациента со стадией фиброза F0 и один пациент со стадией фиброза F2), генотипами ВГС были 1b, 1a и 3 соответственно, при этом схема лечения представляла собой комбинацию СОФ + ДАК + РБВ длительностью 12 недель. В тоже время, у всех пациентов с циррозом был достигнут УВО12, включая двух пациентов с декомпенсацией функций печени. Выявленные побочные эффекты во многом были связаны с использованием РБВ и иммуносупрессией. Наиболее распространенным явлением являлась анемия (n = 34, 50%), что требовало коррекции дозы РБВ в сторону уменьшения (n = 16) или полную отмену его применения (n = 12). Различного рода инфекционные осложнения были вторыми по частоте встречаемых негативных явлений (11,7%). Однако, лишь немногие пациенты нуждались в госпитализации для решения возникших осложнений.
Представленные здесь результаты полностью соответствуют другим клиническим испытаниям и исследованиям проведенным в реальной клинической практике. Castells et al. оценивал лечение СОФ + ДАК длительностью 24 недель проводимое для 22 реципиентов печени с рецидивом ВГС, 56% из которых имели цирроз, 27% декомпенсированный. Все 22 пациента достигли УВО12. Coilly et al. провели многоцентровое когортное исследование ДАК + СОФ для лечения рецидива ВГС после трансплантации печени (исследование CUPIТП): 137 пациентов, 33% с циррозом, большинство имели 1 генотип (79%). УВО12 составлял 96%. Только у двух пациентов произошел вирусологический прорыв, а уровень нежелательных явлений составил 17,5%. Maria в Швеции описала клинический опыт лечения вновь приобретенного ВГС после трансплантации печени: 93 пациента с ВГС 1, 2, 3 или 4 (58, 7,5, 26,5 и 7,5% соответственно) генотипами, получавших СОФ в комбинации с ингибитором протеазы NS3/4A (СИМ) или NS5A (ДАК или LDV), независимо от применения РБВ длительностью 12 или 24 недели. Уровень достижения УВО12 составил 97,8% (91/93 пациента). Qu et al. провели систематический обзор для оценки эффективности и безопасности терапии на основе СОФ у реципиентов печени с рецидивом ВГС и включили 22 исследования (1730 пациентов), УВО12 составил 90,1%. Еще один систематический обзор и метаанализ был опубликован Liao et al., в том числе 7 исследований с 379 реципиентами печени с рецидивом ВГС, получавшим СОФ плюс ДАК. У большинства пациентов был 1 генотип ВГС. Общий показатель УВО12 составил 93,3%. Наиболее распространенными побочными эффектами и нежелательными явлениями были анемия (32%), нейтропения (23%) и инфекционные осложнения (26%).
Наше исследование показало аналогичные результаты с общим уровнем достижения УВО12 >95% и хорошей переносимостью назначенного лечения, используя в качестве основной схемы СОФ + ДАК + РБВ длительностью 12 недель. Тем не менее, у 4 пациентов мы наблюдали развитие сильного отторжения трансплантата после элиминации ВГС. До настоящего времени в предыдущих исследованиях не было отмечено серьезных случаев отторжения. Все упомянутые выше пациенты имели стабильную иммуносупрессию. Интересно, что для лечения такого серьезного отторжения было необходимо возобновление стероидных гормонов, использование высоких доз такролимуса, микофенолата или эверолимуса. При этом, только один пациент несмотря на высокие дозы иммунодепрессантов демонстрировал ухудшения состояния до возникновения хронического отторжения трансплантата. Saksena недавно сообщила о безопасности и эффективности применения ПППД среди реципиентов почек и печени с рецидивом ВГС (исследовании ВГС-TARGET). Произошло шесть эпизодов острого отторжения (1,4%): 2 почек и 4 печени. Частота острого отторжения была такой же, как и у группы пациентов которые получали лечения ВГС. Причина острого отторжения не была напрямую связана с лечением ВГС.
В эпоху применения интерферона отторжение трансплантата было связано с иммуномодулирующим эффектом или улучшением функции печени после элиминации ВГС, а также с изменением фармакокинетики иммунодепрессантов. Современная эра ПППД демонстрирует некоторые иммунологические изменения после лечения ВГС. Martin et al. описали восстановление функции Т-клеток, индуцированной безинтерфероновой терапией. Авторы продемонстрировали гипотезу об истощении лимфоцитов, вызванную постоянным антигенным воздействием ВГС, которое можно восстановить после элиминации ВГС с помощью ПППД. Восстановление этой формы иммунитета может быть причиной отторжения трансплантата, опосредованного Т-лимфоцитами.
Ключевые ограничения данного исследования связаны с ретроспективным характером, небольшой выборкой пациентов с циррозом печени (7 пациентов, 10,2%) и высокой частоте использования РБВ (56 пациентов, 82,3%), что ограничивает оценку влияния РБВ на эффективность и безопасность.
В заключение, терапия ПППД на основе СОФ является высокоэффективной и безопасной для лечения рецидива ВГС после проведения трансплантации печени. Наше исследование выявило несколько случаев сильного отторжения трансплантата у некоторых пациентов после элиминации ВГС, что может быть связано с изменением иммунного ответа после восстановления популяции Т-лимфоцитов. Несмотря на отсутствие явной связи, чтобы установить вероятность реального риска отторжения трансплантата необходимы дальнейшие исследования потенциальных механизмов этого процесса.
Источник:
Sofosbuvir-based antiviral therapy in patients with recurrent HCV infection after liver transplant: A real-life experience
Volume 18, Issue 3, May–June 2019, Pages 450-455
doi.org/10.1016/j.aohep.2018.09.004
Коллектив авторов:
- Alexandre Araujo, Vanessa Valenzuela-Granados, Antonio B. Lopes, Matheus T.Michalczuk, Augusto Mantovani, Mario R. Alvares-da-Silva
- Division of Gastroenterology and Hepatology, Hospital de Clínicas de Porto Alegre, Brazil
- World Gastroenterology Organisation Porto Alegre Hepatology Training Center, Porto Alegre, Brazil
- Universidade Federal do Rio Grande do Sul, Porto Alegre, Brazil
Остались вопросы? Получите ответ на форуме
Имеются противопоказания! Необходима консультация специалиста.



спасибо за интересное исследование