Получено 3 октября 2016 г.; получено с поправками 18 января 2017 г.; принято в печать 20 января 2017 г.; доступно онлайн с 9 февраля 2017 г.
Читать статью в формате PDF: Дженерики ледипасвира-софосбувира для пациентов с хроническим гепатитом C
Актуальность и цели
В развивающихся странах немногие пациенты с гепатитом C могут позволить себе лечение оригинальными противовирусными препаратами прямого действия, в то же время существуют сомнения в биоэквивалентности воспроизведенных препаратов. Настоящее исследование посвящено оценке безопасности и эффективности приема в течение 8 или 12 нед. воспроизведенного препарата ледипасвира-софосбувира в сочетании с рибавирином или без него у пациентов из Китая с гепатитом C генотипа 1b.
Методы
В этом открытом обсервационном исследовании участвовало 63 пациента с циррозом (группа 1) и 65 пациентов без цирроза печени (группа 2), которые получали воспроизведенный препарат ледипасвира-софосбувира + 1000–1200 мг рибавирина в сутки в течение 12 и 8 нед. соответственно, а также 64 пациента без цирроза (группа 3), получавшие оригинальный ледипасвир-софосбувир в течение 8 нед. Первичным показателем эффективности считалась неопределяемая РНК HCV через 12 нед. после окончания лечения (УВО12). Также собирались данные по безопасности и фармакокинетике.
Результаты
Лечение завершило 187 пациентов; при последнем анализе на 5-й неделе лечения РНК HCV была ниже определяемого уровня у 3 пациентов с циррозом. Анализ у всех пациентов, начавших лечение, показал частоту УВО12 96,8 (61 из 63), 96,9 (63 из 65) и 96,9 % (62 из 64) в группах 1, 2 и 3 соответственно. У 1 пациента в группе 3 отмечен рецидив на 4-й неделе после окончания лечения.
Схемы терапии в целом хорошо переносились. Наиболее частыми нежелательными явлениями были слабость (17,8 %), диарея (10,9 %) и головная боль (9,9 %). 4 пациента прервали лечение из-за диареи и рвоты. 1 пациентка из группы 2 прервала лечение на 29-й день из-за невозможности приобрести препарат; к счастью, она достигла УВО12.
Выводы
Настоящее исследование показало, что 8 или 12 нед. приема дженериков ледипасвира-софосбувира в сочетании с рибавирином или без него безопасно и эффективно у пациентов с гепатитом C генотипа 1b.
Резюме
Высокая стоимость Харвони ограничивает доступ к препарату для пациентов многих развивающихся и некоторых развитых стран с небольшим бюджетом на нужды здравоохранения. Компания Gilead одобрила воспроизведенный препарат ледипасвира-софосбувира, стоимость которого намного ниже, чем у Харвони, и который обеспечивает ту же частоту излечения пациентов с хроническим гепатитом C.
Введение
Хронический гепатит C — глобальная проблема здравоохранения, во всем мире им заражено 130–170 млн человек; хронический гепатит C (ХГС) является основной причиной цирроза и гепатоцеллюлярного рака (ГЦР) [1–3]. В Китае общая распространенность гепатита C составляет, по оценкам, 2,2 % [1]. В провинции Хэнань заболеваемость достигает 9,6 % вследствие более высокой частоты передачи инфекции через кровь [1, 2, 4]. Генотип 1 наиболее часто встречается в Китае, вирусом с этим генотипом инфекция вызвана у 58,4 % всех пациентов с гепатитом C; в основном отмечается генотип 1b [1, 2].
Многие исследования показывают, что инфекция, вызванная вирусом гепатита C (HCV) генотипа 1, трудно поддается лечению по сравнению с генотипами 2 и 3 в эру пэгилированного интерферона-α + рибавирин (схема PegIFN + RBV) [1, 5]. Недавнее исследование выявило, что пациенты с HCV генотипа 1b имеют больший риск развития ГЦР, чем пациенты с инфекцией других подтипов [6]. Таким образом, гепатит C, вызванный HCV генотипа 1b, представляет серьезную проблему здравоохранения в Китае.
В настоящее время стандартом лечения в этой стране остается схема PegIFN + RBV. Во всем мире эта устаревшая схема при ХГC дает устойчивый вирусологический ответ (УВО) примерно 40 % у пациентов с HCV генотипа 1 и 75 % у пациентов с генотипом 2 или 3 [5, 7]. К счастью, частота УВО при применении PegIFN + RBV у китайских пациентов с ХГC генотипа 1 выше, чем у европейских пациентов [1–3].
Показано, что на ответ на лечение PegIFN + RBV влияет несколько факторов, связанных с хозяином, вирусом и самой инфекцией [5, 8]. Основная причина — полиморфизм гена интерлейкина-28B (IL28B) [9]. Благоприятные генотипы IL28B (rs12979860 CC и rs8099917 TT) связаны с повышением частоты УВО в 2–3 раза при лечении PegIFN + RBV при гепатите C генотипа 1 [9]; при этом 91,75 % китайских пациентов с ХГC имеют генотип rs12979860 CC [10].
Однако хорошо известно, что схема PegIFN + RBV имеет ряд противопоказаний и нежелательных явлений, поэтому может плохо переноситься и давать низкую приверженность у некоторых пациентов. Сочетание неблагоприятной частоты УВО, плохой переносимости и приверженности оправдывает разработку новых противовирусных препаратов.
Первый среди противовирусных препаратов прямого действия (ПППД) софосбувир совершил переворот в лечении ХГC начиная с 2013 г. [11]. Софосбувир — нуклеотидный аналог ингибитора полимеразы NS5B HCV, ледипасвир — ингибитор NS5A HCV [12–16]. Оба ПППД имеют взаимодополняющий механизм действия.
Фиксированное сочетание ледипасвира и софосбувира в одной таблетке одобрено в западных странах на основе результатов 3 исследований III фазы (ION-1, ION-2 и ION-3) [14–16]. Рекомендации Европейской ассоциации по изучению печени (EASL) по лечению гепатита C за 2016 г. предполагают, что пациенты без цирроза печени с гепатитом C генотипа 1 могут получать лечение препаратом с фиксированным сочетанием ледипасвира и софосбувира 1 раз в сутки в течение 12 нед.; у ранее не леченных пациентов без цирроза курс лечения может быть сокращен до 8 нед., если исходный уровень РНК HCV у них не более 6 млн (6,8 log10) МЕ/мл [17].
Пациенты с циррозом должны получать это фиксированное сочетание препаратов в течение 12 нед. + ежедневная доза RBV в зависимости от массы тела (1000 или 1200 мг у пациентов с массой тела менее или более 75 кг соответственно) или в течение 24 нед. без RBV [17].
Китай — развивающаяся страна с наибольшим количеством HCV-инфицированных жителей в мире [1]. Но оригинальные ПППД там недоступны. К счастью, компания Gilead Sciences Inc. одобрила воспроизведенный препарат ледипасвира-софосбувира с очень низкой стоимостью во многих странах, граничащих с Китаем, и пациенты могут отправиться в эти страны, чтобы приобрести там средство для лечения.
Так, 15 декабря 2015 г. компания Indian Natco Pharma Limited сообщила о получении одобрения на воспроизведенный препарат ледипасвира-софосбувира (Гепцинат ЛП) после подписания неэксклюзивного лицензионного соглашения с Gilead Sciences в 2015 г.; ранее ледипасвир-софосбувир продавался Gilead Sciences Inc. во всем мире под оригинальным названием Харвони®.
Однако существуют некоторые сомнения в отношении биоэквивалентности воспроизведенного и оригинального препаратов [18, 19], а данные о безопасности и эффективности воспроизведенного препарата ледипасвира-софосбувира отсутствуют. В настоящем исследовании мы сообщаем о безопасности и эффективности воспроизведенного препарата ледипасвира-софосбувира при приеме в течение 8 и 12 нед. у китайских пациентов с ХГC, вызванным HCV генотипа 1b.
Пациенты и методы
Критерии включения и исключения
В настоящее открытое исследование включали пациентов, которые исходно отвечали следующим критериям: 1) возраст 30–70 лет; 2) ХГC в анамнезе; 3) HCV генотипа 1b; 4) с циррозом или без, включая компенсированную и декомпенсированную формы (без варикозного расширения вен пищевода и печеночной энцефалопатии); 5) ранее не получавшие лечение; 6) уровень альбумина > 30 г/л, гемоглобина > 85 г/л, тромбоцитов > 50 × 109/л, активность протромбинового времени > 60 %; 7) отрицательные результаты на гепатиты A, B и E, вирус Эпштейна—Барр, цитомегаловирус и ВИЧ, а также антинуклеарные антитела и антитела к гладким мышцам и митохондриям.
Оценка пациентов перед началом исследования
Следующие клинические тесты были проведены всем пациентам в течение первых визитов: ЭКГ; антитела к вирусам гепатита A и E, сывороточный поверхностный антиген вируса гепатита B и антитела к ВИЧ, антитела к HCV, уровень РНК HCV и генотип HCV; функция щитовидной железы; уровень глюкозы крови, активность протромбинового времени, аутоантитела, уровень α-фетопротеина и биохимический анализ крови; лучевое исследование брюшной полости; исследования плотности печени.
Уровень сывороточной РНК HCV отслеживался с помощью устройств Roche COBAS® AmpliPrep/COBAS® TaqMan® (Roche Molecular Systems, США; версия 3.0, порог определения 15 МЕ/мл). Реактивность антител к HCV определялась с помощью устройства VITROS® (усиленный электрохемилюминесцентный анализ) (Ortho-Clinical Diagnostics, США). Генотип HCV анализировался путем секвенирования генов.
Цирроз диагностировался на основании как минимум двух лучевых исследований (т. е. УЗИ брюшной полости, FibroScan®, компьютерная томография или магнитно-резонансная томография) плюс наличие клинических проявлений. Плотность печени более 12,5 кПа указывала на цирроз у пациентов без асцита [20]. Скрининг на ГЦР проводился с помощью как минимум двух лучевых исследований или одного лучевого исследования, если сывороточный уровень α-фетопротеина составлял не менее 400 нг/мл [21].
Схемы лечения
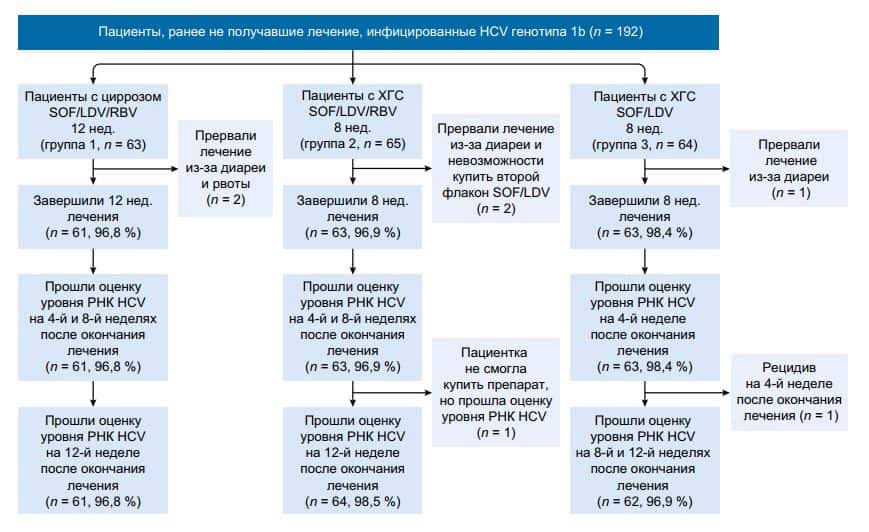
192 пациента, купивших воспроизведенный препарат ледипасвира-софосбувира при самостоятельной поездке с медицинскими целями в соседние страны с Китаем, были разделены на три группы (рис. 1). Пациенты с циррозом, вызванным гепатитом C, попали в группу 1 (n = 63); они получали фиксированное сочетание 90 мг ледипасвира и 400 мг софосбувира (1 раз в сутки) и RBV (1000 или 1200 мг в сутки в три приема у пациентов с массой тела менее или более 75 кг соответственно) в течение 12 нед.
Пациенты с ХГC в группе 2 (n = 65) получали воспроизведенный препарат ледипасвира-софосбувира 1 раз в сутки + RBV в течение 8 нед. Пациенты с ХГC в группе 3 (n = 64) получали ледипасвир-софосбувир 1 раз в сутки без RBV в течение 8 нед. Воспроизведенный препарат ледипасвира-софосбувира (Гепцинат ЛП) был одобрен компанией Gilead Sciences в 2015 г. и выпускается компанией Indian Natco Pharma Limited.
Оценка во время противовирусной терапии
Уровень РНК HCV, ЭКГ, биохимический и другие анализы крови на различные показатели проводились 1 раз в неделю до тех пор, пока уровень РНК HCV не переставал определяться, затем каждые 4 нед. до 12 (группа 1) или 8 нед. (группы 2 и 3) и вновь на 4, 8 и 12-й неделях после окончания лечения.
Оценка эффективности и безопасности
Основным показателем эффективности считался УВО, за который принимался неопределяемый уровень РНК HCV через 12 нед. после окончания лечения (УВО12). Фиксировались также нежелательные явления во время и после лечения. Скрининг на ГЦР проводился в конце лечения и через 12 нед. после его окончания.
Оценка размеров выборки
Одной из целей, с которыми было разработано данное исследование, была демонстрация того, что различия частоты УВО между воспроизведенным и оригинальным препаратом (последний — по историческим данным) не меньше чем «–предел не меньшей эффективности» (–∆), диапазон которого составлял от –0,12 до –0,15 в предыдущих исследованиях [16, 22].
В настоящем исследовании ∆ был установлен на высокий показатель –0,12 [16], а контролируемая частота УВО для оригинального препарата ледипасвира-софосбувира — на 95 % на основании предыдущих исследований [16, 17]. Уровень односторонней значимости был установлен на 0,05 с высоким стандартом мощности (1 – β) 0,9.
Таким образом, расчетный размер выборки был равен 56 в каждой группе согласно формуле, описанной Christensen [23]; этот размер был округлен до 62, чтобы учесть высокий уровень отказов от лечения (10 %) на основе текущей терапии ПППД. Общее количество пациентов в трех группах, требуемое для этого исследования, составило по крайней мере 186 человек.
Статистический анализ
Непрерывные переменные суммировались как среднее со стандартным отклонением или медианы с диапазоном. Доля пациентов каждой категории вычислялась как категориальная переменная. Доли сравнивались между различными группами с помощью критерия χ2. Двусторонний показатель p < 0,05 считался статистически значимым.
Анализы проводились с помощью программного обеспечения SPSS версии 16.0 для Windows (SPSS Inc, США). 95%-е доверительные интервалы (95% ДИ) вычислялись с помощью статистического калькулятора EpiCalc 2000 (версия 1.02).
Информированное согласие и этические нормы
Все процедуры проводились в соответствии с этическими стандартами (институционными и национальными) и с Хельсинкской декларацией 1975 г. пересмотра 2008 г. Информированное согласие на все обсервационные процессы было получено у всех пациентов до включения в исследование. Обсервационный протокол был одобрен институционной комиссией до начала исследования.
Результаты
Характеристика участников
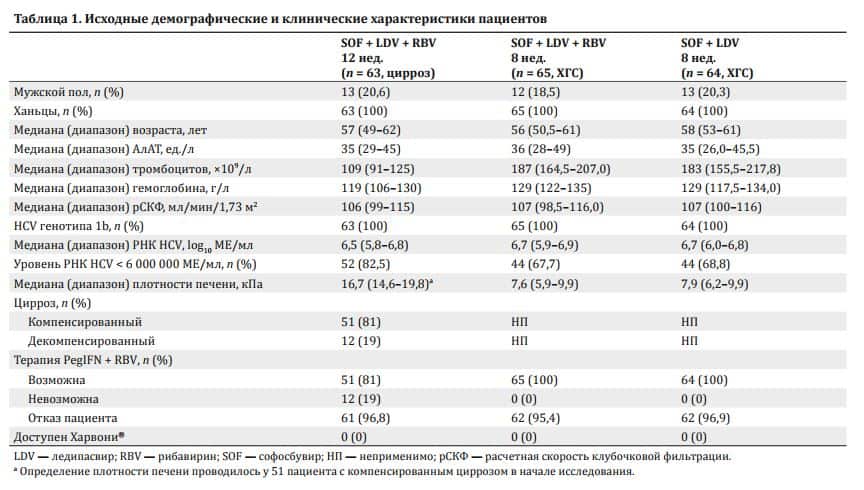
С марта по июнь 2016 г. в исследование было набрано и пролечено 192 пациента, ранее не получавших терапии (с циррозом, группа 1, n = 63) и ХГC (группы 2 и 3, n = 65 и n = 64 соответственно) (см. рис. 1). Демографические и исходные клинические характеристики пациентов были в целом сбалансированы между тремя группами (табл. 1). Во всех трех группах каждый пациент имел гепатит C генотипа 1b и был представителем ханьцев.
Большая часть участников была женского пола (154 из 192; 80,2 %). Средний возраст и средний уровень РНК HCV составили 55,8 года (диапазон 35–70 лет) и 6,4 log10 МЕ/мл (диапазон 4,2–7,9 log10 МЕ/мл) соответственно. Уровень РНК HCV < 6 млн МЕ/мл отмечался у 67,7 (44 из 65) и 68,8 % (44 из 64) пациентов из групп 2 и 3 соответственно.
Интересно, что 93,8 % (180 из 192) пациентов подходили для терапии PegIFN + RBV, однако 96,4 % (185 из 192) человек отказались получать PegIFN + RBV, предпочтя терапию воспроизведенным препаратом ледипасвира-софосбувира. В целом 97,4 % (187 из 192) пациентов завершили полный курс лечения; 1 пациентка из группы 2 прекратила лечение на 29-й день из-за отсутствия средств на покупку второго флакона воспроизведенного препарата ледипасвира-софосбувира.
Кинетика вируса
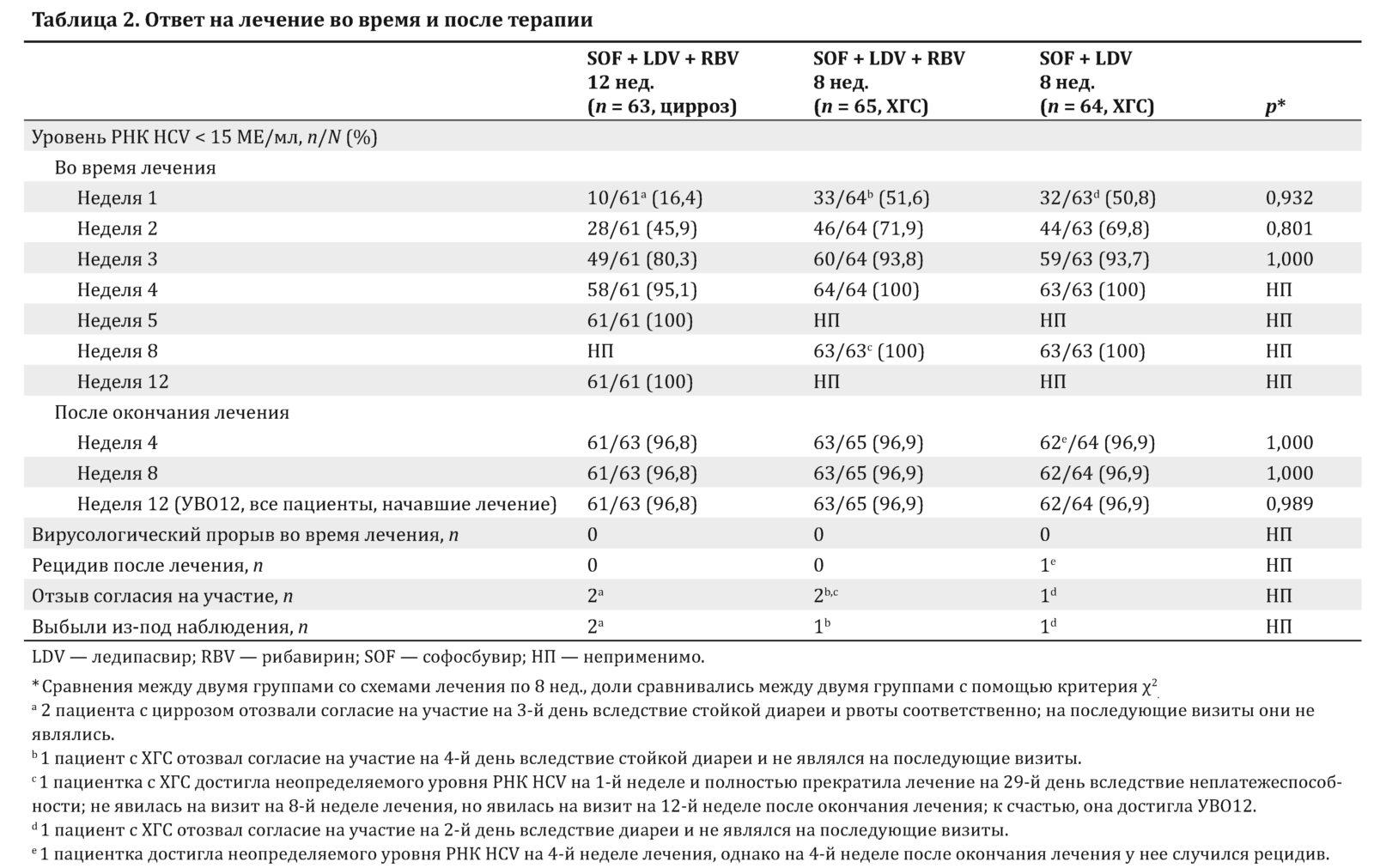
Неопределяемый уровень РНК HCV был достигнут у 40,1 (75 из 187; 95% ДИ 33,1–47,5 %), 63,1 (118 из 187; 95% ДИ 55,7–69,9 %), 89,8 (168 из 187; 95% ДИ 84,4–93,6 %) и 98,4 % (184 из 187; 95% ДИ 95,0–99,6 %) пациентов, прошедших полный курс, на 1, 2, 3 и 4-й неделях лечения соответственно. 3 пациента с циррозом из группы 1 достигли неопределяемого уровня РНК HCV на 5-й неделе терапии.
Значительных различий между группами 2 и 3 по частоте неопределяемого уровня РНК HCV во время лечения не наблюдалось (табл. 2). Однако такие различия были выявлены между группами 1 и 3 на 1 (p < 0,0001), 2 (p = 0,007) и 3-й (p = 0,027) неделях лечения, тогда как с 4-й недели (p = 0,231) значительных различий не отмечалось.
Противовирусная эффективность
Все пациенты из группы 1, завершившие лечение (n = 61), достигли неопределяемого уровня РНК HCV к 5-й неделе лечения и последнему визиту. Кроме того, все пациенты группы 2, завершившие лечение (n = 63), достигли неопределяемого уровня РНК HCV к 4-й неделе лечения.
Анализ у всех пациентов, начавших лечение, показал, что 96,8 (61 из 63; 95% ДИ 88,0–99,5 %), 96,9 (63 из 65; 95% ДИ 88,4–99,5 %) и 96,9 % (62 из 64; 95% ДИ 88,2–99,5 %) пациентов в группах 1, 2 и 3 соответственно имели УВО12 (см. табл. 2). Анализ по протоколу выявил, что 100 (61 из 61; 95% ДИ 92,6–99,9 %), 100 (63 из 63; 95% ДИ 92,8–99,9 %) и 98,4 % (62 из 63; 95% ДИ 90,3–99,9 %) пациентов в группах 1, 2 и 3 соответственно имели УВО12 (см. табл. 2).
У пациентов с уровнем РНК HCV < 6 млн МЕ/мл анализ всех начавших лечение показал, что 95,5 (42 из 44; 95% ДИ 83,3–99,2 %) и 97,7 % (43 из 44; 95% ДИ 86,5–99,9 %) участников в группах 2 и 3 соответственно достигли УВО12; анализ по протоколу обнаружил, что 100 (42 из 42; 95% ДИ 89,6–99,8 %) и 100 % (43 из 43; 95% ДИ 89,8–99,8 %) пациентов из групп 2 и 3 достигли УВО12 соответственно. У пациентов с уровнем РНК HCV > 6 млн МЕ/мл оба анализа показали 100 (21 из 21; 95% ДИ 80,8–99,6 %) и 95 % (19 из 20; 95% ДИ 73,1–99,7 %) УВО12 в группах 2 и 3 соответственно.
К сожалению, одна 41-летняя пациентка из группы 2 прервала лечение на 29-й день из-за невозможности купить препарат, однако, к нашему удивлению, она достигла УВО12. Уровень РНК HCV у нее был 397 500 МЕ/мл, активность аланинаминотрансферазы (АлАТ) 34 ед./л, и она достигла неопределяемого уровня РНК HCV на 1-й неделе лечения.
Лишь 1 пациент из группы 3 не достиг УВО12. Это была 61-летняя женщина с ХГC, у которой развился рецидив на 4-й неделе после окончания лечения. Уровень РНК HCV у нее был 15 900 000 МЕ/мл, активность АлАТ 29 ед./л до начала лечения, и она достигла неопределияемого уровня РНК HCV к 4-й неделе лечения.
При анализе не меньшей эффективности частота УВО в трех группах была не меньше, чем частота ответа в исторических контролируемых исследованиях [17], т. е. нижние границы ДИ для различий частоты УВО между текущим воспроизведенным и историческим контролируемым оригинальным препаратом были выше, чем предустановленный порог не меньшей эффективности –12 %.
Приверженность, безопасность и нежелательные явления
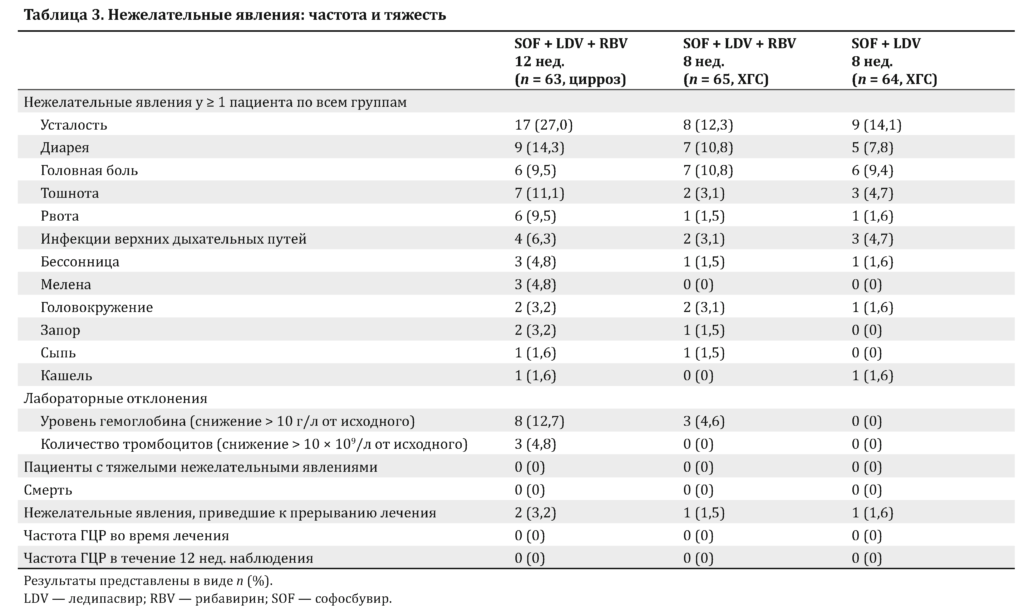
Терапия воспроизведенным препаратом ледипасвира-софосбувира с RBV или без него в целом хорошо переносилась пациентами всех трех групп, кроме 4 пациентов, которые прервали лечение из-за диареи (n = 3) и рвоты (n = 1). Тяжелых угрожающих жизни нежелательных явлений не наблюдалось.
Наиболее частыми нежелательными явлениями были усталость (17,7 %, 34 из 192; 95% ДИ 12,7–24,0 %), диарея (10,9 %, 21 из 192; 95% ДИ 7,1–16,4 %) и головная боль (9,9 %, 19 из 192; 95% ДИ 6,2–15,2 %) (табл. 3). Снижение уровня гемоглобина и числа тромбоцитов от исходного во время лечения чаще всего отмечалось в группе 1 (см. табл. 3). Случаев ГЦР к концу лечения и к моменту УВО12 не выявлено.
Обсуждение
По оценкам, в Китае наибольшая распространенность гепатита C в мире. Обычные и продленные схемы PegIFN + RBV остаются стандартом лечения для ранее не леченных и леченных пациентов с ХГC соответственно. Тем не менее у этой схемы существуют недостатки, такие как субоптимальная частота УВО, нежелательные явления и плохая переносимость.
Назначение ПППД с четкими вирусными мишенями, которые делают препараты высокоэффективными, может способствовать элиминации HCV; при этом они хорошо переносятся и дают меньше нежелательных явлений [11]. В рекомендациях EASL по лечению гепатита C за 2016 г. говорится, что пациенты с ХГC генотипа 1b и компенсированным циррозом должны получать ледипасвир-софосбувир в течение 8–12 нед. в сочетании с RBV или без него [17]. К сожалению, жителей развивающихся стран, включая Китай, останавливает высокая стоимость оригинального препарата.
Однако компания Gilead одобрила воспроизведенный препарат ледипасвира-софосбувира, выпускаемый в соседних с Китаем странах; этот препарат предоставляет возможность лечения для китайцев. Между тем существуют сомнения в биоэквивалентности и разнице контроля качества между воспроизведенным и оригинальным препаратом [19]; иными словами, во всем мире отсутствуют данные о безопасности и эффективности воспроизведенного препарата.
Наше исследование показало, что воспроизведенный ледипасвир-софосбувир с RBV или без него эффективен и хорошо переносится пациентами с гепатитом C генотипа 1b, хотя 4 пациента прервали терапию из-за рвоты и диареи. Следует заметить, что диарея, по нашим данным, является вторым по частоте нежелательным явлением при приеме воспроизведенного препарата ледипасвира-софосбувира, что отличается от результатов многих предыдущих исследований [14, 15, 24, 25].
Хорошо известно, что ряд факторов, связанных с вирусом, хозяином и заболеванием, видоизменяет ответ на лечение гепатита C [1]. Предыдущие исследования показали, что однонуклеотидный полиморфизм гена IL28B хозяина связан с ответом на схему PegIFN + RBV (т. е. rs12979860 и rs8099917) [9].
Однако множество недавних исследований демонстрирует, что однонуклеотидный полиморфизм гена IL28B утратил прогностическую ценность при лечении высокоэффективными ПППД [17, 20, 24–26]. Поэтому мы не включали генотипирование по IL28B в настоящее исследование. Гепатит C генотипа 1b трудно поддается лечению не только при прежних, но и при текущих стандартах терапии по сравнению с генотипами 2 и 3 [17].
Более того, недавнее исследование выявило, что нелеченные пациенты с HCV генотипа 1b имеют более высокий риск развития ГЦР, чем пациенты, инфицированные вирусами других генотипов (25,9 vs 20,1 %) [6]. Недавно несколько исследователей сообщили, что высокая заболеваемость и частота рецидивов ГЦР наблюдались у пациентов с тяжелым поражением печени во время терапии ПППД и после достижения УВО соответственно [27–29], хотя высказывались и противоположные мнения [30–32].
В настоящем исследовании не отмечалось случаев ГЦР у пациентов, получавших воспроизведенный препарат ледипасвира-софосбувира во время лечения и к 12-й неделе после его окончания. Кроме того, в последних рекомендациях EASL по лечению гепатита C за 2016 г. сказано, что пациенты с компенсированным циррозом и HCV генотипа 1b могут получать лечение ледипасвиром-софосбувиром в течение 12 нед. в сочетании с RBV, хотя данные для пациентов с декомпенсированным циррозом ограничены [17].
В настоящем исследовании у 12 (19 %) из 63 пациентов в группые 1 был диагностирован декомпенсированный цирроз; 91,7 (11 из 12; 95% ДИ 59,8–99,6 %) и 100 % (11 из 11; 95% ДИ 67,9–99,2 %) пациентов достигли УВО по результатам анализа всех начавших лечение и анализа по протоколу соответственно.
Для пациентов без цирроза, таких как ранее не леченные пациенты из групп 2 и 3, рекомендации EASL по лечению гепатита C от 2016 г. предлагают терапию ледипасвиром-софосбувиром в течение 12 нед. без RBV; при этом лечение может быть сокращено до 8 нед. при исходном уровне РНК HCV < 6 млн МЕ/мл [17].
Однако недавние исследования в реальной практике дали другие заключения [24, 25]. В настоящем исследовании уровень РНК HCV < 6 млн МЕ/мл отмечался у 67,7 (44 из 65) и 68,8 % (44 из 64) пациентов из групп 2 и 3 соответственно; анализ у всех пациентов, начавших лечение, показал, что 95,5 (42 из 44) и 97,7 % (43 из 44) участников достигли УВО12 в этих группах соответственно.
К тому же 100%-я (21 из 21) и 95%-я (19 из 20) частота УВО12 наблюдалась у пациентов с уровнем РНК HCV > 6 млн МЕ/мл из групп 2 и 3 соответственно. Несмотря на то что добавление к схеме RBV неоднозначно в эру ПППД и может быть благоприятным в ситуациях с гепатитом C генотипа 1 у ранее леченных пациентов и пациентов с циррозом [33], неизвестно, способен ли RBV повысить частоту УВО у пациентов с уровнем РНК HCV > 6 млн МЕ/мл при лечении ледипасвиром-софосбувиром в течение 8 нед.
На самом деле в настоящее время частоту излечения гепатита C ограничивают отнюдь не нежелательные явления, а цены и доступность препаратов. Стоимость Харвони® привела к ограничению доступа к препарату во многих развивающихся и даже развитых странах с небольшим бюджетом на здравоохранение [18].
На основе обратной связи от пациентов мы выяснили, что Харвони® стоит примерно 31 500 долларов США за флакон (28 таблеток); таким образом, на курс в 8 и 12 нед. требуется 63 000 и 94 500 долларов США соответственно; в то же время воспроизведенный препарат ледипасвира-софосбувира стоит примерно 300 долларов США за флакон (28 таблеток), а на курс в 8 и 12 нед. необходимо 600 и 900 долларов США соответственно.
Как Харвони®, так и воспроизведенный препарат доступны только путем медицинского туризма в регионы и страны по соседству с Китаем, в частности Гонконг и Индию. Таким образом, пациенты вынуждены оплачивать стоимость лечения самостоятельно. Между тем сегодня в Китае стоимость курса 24 и 48 нед. PegIFN + RBV составляет примерно 4322,5 и 8645 долларов США соответственно с обычным возмещением по страховке от 0 (амбулаторное лечение) до 80 % (стационар).
В настоящем исследовании ни один участник не мог позволить себе Харвони® (см. табл. 1); с другой стороны, подавляющее большинство пациентов не хотели лечиться PegIFN + RBV, учитывая доступность воспроизведенного препарата из соседних с Китаем стран. К сожалению, 1 пациентка из группы 2 не имела финансовых возможностей даже на покупку второго флакона воспроизведенного препарата, хотя он стоил всего около 300 долларов США за флакон [34, 35].
Однако этой пациентке все же удалось достичь УВО12, что может указывать на то, что длительность лечения может быть меньше 8 нед., и последнее исследование Lau et al. поддерживает эту гипотезу [36]. Таким образом, снижение стоимости ПППД тем или иным путем, например за счет сокращения курса лечения и за счет импорта воспроизведенного препарата, и повышение его доступности для эрадикации HCV станут ключевыми целями в будущем.
Без сомнений, широкое применение недорогих и доступных воспроизведенных ПППД может разительно повлиять на глобальное бремя связанных с HCV заболеваний. Следует заметить, что препараты, не лицензированные китайским правительством, включая как оригинальные, так и воспроизведенные ПППД, не допускаются к продаже на основной территории страны из соображений безопасности, поскольку нет гарантий, что процесс производства соответствует национальным стандартам Китая.
Однако отдельным гражданам разрешается ввозить нелицензированный препарат путем медицинского туризма на свой собственный риск. К сожалению, многие неосведомленные и бедные пациенты не имеют доступа даже к недорогому воспроизведенному препарату путем медицинского туризма.
Эти обстоятельства показывают, что на настоящий момент масштабные формы национальных и личных схем импорта невозможны к широкому применению. Тем не менее на такие масштабные меры существует спрос, поскольку заболевания, связанные с HCV, склонны к прогрессированию и могут угрожать жизни.
Недавно был предпринят ряд клинических исследований оригинальных ПППД, и можно ожидать, что некоторые оригинальные ПППД будут выпускаться на основной территории Китая. И все же на основе последних данных новые препараты обычно дороги, и маловероятно, что будут покрываться страховыми программами.
В настоящее время низкие личные страховые премии ведут к невозможности возместить эти препараты, используя объединенные страховые фонды. Например, в 2016 г. сельские жители, составляющие большую часть населения Китая, платили всего около 17,6 долларов США (120 юаней) в год на человека за страхование здоровья.
На основе благоприятного профиля безопасности и эффективности воспроизведенного препарата ледипасвира-софосбувира в настоящем исследовании мы обращаемся к китайскому правительству с призывом преодолеть юридические, экономические и производственные барьеры, мешающие допустить масштабный национальный импорт готовых и недорогих воспроизведенных ПППД для лечения HCV-инфицированного населения, как и развивать китайское общество и экономику в будущем.
В заключение отметим, что это обсервационное исследование впервые показало, что 8–12 нед. лечения воспроизведенным препаратом ледипасвира-софосбувира в сочетании с RBV или без него безопасны и эффективны для ранее не леченных пациентов с ХГC и пациентов с циррозом и HCV генотипа 1b и имеют не меньшую эффективность, чем лечение оригинальным препаратом, хотя прямое сравнение не проводилось. В будущем оправданы валидационные исследования с участием большего количества пациентов и более короткими курсами лечения.
Спонсоры
Исследование получило поддержку Национального фонда естественных наук Китая (№ 81302593) и проекта ключевых научных исследований Хэнаньских институтов высшего образования в Китае (№ 15A320083).
Конфликты интересов
Авторы, принимавшие участие в исследовании, заявляют об отсутствии конфликтов интересов в отношении финансирования или написания рукописи.
Вклад авторов
Вклад Qing-Lei Zeng, Guang-Hua Xu, Ji-Yuan Zhang, и Wei Li равноценен как совместных главных авторов. Qing-Lei Zeng, Guang-Hua Xu и Ji-Yuan Zhang, Wei Li и Zu-Jiang Yu разрабатывали концепцию и дизайн исследования. Все авторы участвовали в сборе и интерпретации данных, написании черновика и вычитке данной рукописи. Все авторы согласились с окончательной версией рукописи.
Благодарности
Мы благодарим пациентов и их родственников за сотрудничество в отношении оценок во время лечения и наблюдения.
Литература
- Wei L, Lok AS. Impact of new hepatitis C treatments in different regions of the world. Gastroenterology 2014;146:1145–1150 e1141–e1144.
- Wang FS, Fan JG, Zhang Z, Gao B, Wang HY. The global burden of liver disease: the major impact of China. Hepatology 2014;60:2099–2108.
- Cui Y, Jia J. Update on epidemiology of hepatitis B and C in China. J Gastroenterol Hepatol 2013;28:7–10.
- Zeng QL, Yu ZJ. Prevalence of hepatitis C virus and hepatitis B virus infections in patients infected with HIV through blood donation or transfusion in china. AIDS Res Hum Retroviruses 2015;31:1203.
- European Association for the Study of the Liver. EASL Clinical Practice Guidelines: management of hepatitis C virus infection. J Hepatol 2011;55:245–264.
- Lee MH, Yang HI, Lu SN, et al. Hepatitis C virus genotype 1b increases cumulative lifetime risk of hepatocellular carcinoma. Int J Cancer 2014;135:1119–1126.
- McHutchison JG, Lawitz EJ, Shiffman ML, et al. Peginterferon alfa-2b or alfa-2a with ribavirin for treatment of hepatitis C infection. N Engl J Med 2009;361:580–593.
- European Association for the Study of the Liver. EASL recommendations on treatment of hepatitis C 2014. J Hepatol 2014;61:373–395.
- Ge D, Fellay J, Thompson AJ, et al. Genetic variation in IL28B predicts hepatitis C treatment-induced viral clearance. Nature 2009;461:399–401.
- Rao H, Wei L, Li H, et al. Prevalence of abnormal glycometabolism in treatment-naive patients with hepatitis C virus infection in a Chinese Han population. J Gastroenterol Hepatol 2015;30:1049–1056.
- Zeng QL, Zhang JY, Zhang Z, Wang LF, Wang FS. Sofosbuvir and ABT-450: terminator of hepatitis C virus? World J Gastroenterol 2013;19:3199–3206.
- Gane EJ, Stedman CA, Hyland RH, et al. Nucleotide polymerase inhibitor sofosbuvir plus ribavirin for hepatitis C. N Engl J Med 2013;368:34–44.
- Gao M, Nettles RE, Belema M, et al. Chemical genetics strategy identifies an HCV NS5A inhibitor with a potent clinical effect. Nature 2010;465:96–100.
- Afdhal N, Reddy KR, Nelson DR, et al. Ledipasvir and sofosbuvir for previously treated HCV genotype 1 infection. N Engl J Med 2014;370:1483–1493.
- Afdhal N, Zeuzem S, Kwo P, et al. Ledipasvir and sofosbuvir for untreated HCV genotype 1 infection. N Engl J Med 2014;370:1889–1898.
- Kowdley KV, Gordon SC, Reddy KR, et al. Ledipasvir and sofosbuvir for 8 or 12 weeks for chronic HCV without cirrhosis. N Engl J Med 2014;370:1879–1888.
- European Association for the Study of the Liver. EASL recommendations on treatment of hepatitis C 2016. J Hepatol 2017;66:153–194.
- Ghinea N, Lipworth W, Day R, et al. Importation of generic hepatitis C therapies: bridging the gap between price and access in high-income countries. Lancet 2016, [Epub ahead of print].
- Sarpel D, Dieterich D. The use of generics to treat chronic hepatitis C: not quite ready for the big stage. Liver Int 2016;36:933–935.
- Lai CL, Wong VW, Yuen MF, et al. Sofosbuvir plus ribavirin for the treatment of patients with chronic genotype 1 or 6 hepatitis C virus infection in Hong Kong. Aliment Pharmacol Ther 2016;43:96–101.
- Loomba R, Yang HI, Su J, et al. Synergism between obesity and alcohol in increasing the risk of hepatocellular carcinoma: a prospective cohort study. Am J Epidemiol 2013;177:333–342.
- Lawitz E, Mangia A, Wyles D, et al. Sofosbuvir for previously untreated chronic hepatitis C infection. N Engl J Med 2013;368:1878–1887.
- Christensen E. Methodology of superiority vs. equivalence trials and non-inferiority trials. J Hepatol 2007;46:947–954.
- Backus LI, Belperio PS, Shahoumian TA, Loomis TP, Mole LA. Real-world effectiveness of ledipasvir/sofosbuvir in 4,365 treatment-naive, genotype 1 hepatitis C-infected patients. Hepatology 2016;64:405–414.
- Terrault NA, Zeuzem S, Di Bisceglie AM, et al. Effectiveness of ledipasvir-sofosbuvir combination in patients with hepatitis C virus infection and factors associated with sustained virologic response. Gastroenterology 2016;151:1131–1140 e1135.
- Zeng QL, Li CX, Zhang DW, et al. Letter: safety and efficacy of sofosbuvir plus daclatasvir with ribavirin for 12 weeks in Chinese treatment-experienced cirrhotic genotype 1b patients with HCV. Aliment Pharmacol Ther 2016;43:842–843.
- Kozbial K, Moser S, Schwarzer R, et al. Unexpected high incidence of hepatocellular carcinoma in cirrhotic patients with sustained virologic response following interferon-free direct-acting antiviral treatment. J Hepatol 2016;65:856–858.
- Reig M, Marino Z, Perello C, et al. Unexpected high rate of early tumor recurrence in patients with HCV-related HCC undergoing interferon-free therapy. J Hepatol 2016;65:719–726.
- Conti F, Buonfiglioli F, Scuteri A, et al. Early occurrence and recurrence of hepatocellular carcinoma in HCV-related cirrhosis treated with direct-acting antivirals. J Hepatol 2016;65:727–733.
- Zeng QL, Li ZQ, Liang HX, et al. Unexpected high incidence of hepatocellular carcinoma in patients with hepatitis C in the era of DAAs: Too alarming? J Hepatol 2016;65:1068–1069.
- Cheung MC, Walker AJ, Hudson BE, et al. Outcomes after successful direct-acting antiviral therapy for patients with chronic hepatitis C and decompensated cirrhosis. J Hepatol 2016;65:741–747.
- ANRS collaborative study group on hepatocellular carcinoma (ANRS CO22 HEPATHER, CO12 CirVir and CO23 CUPILT cohorts). Lack of evidence of an effect of direct-acting antivirals on the recurrence of hepatocellular carcinoma: Data from three ANRS cohorts. J Hepatol 2016;65:734–740.
- Hezode C, Bronowicki JP. Ideal oral combinations to eradicate HCV: The role of ribavirin. J Hepatol 2016;64:215–225.
- Freeman JA, Hill A. The use of generic medications for hepatitis C. Liver Int 2016;36:929–932.
- Jensen DM, Sebhatu P, Reau NS. Generic medications for hepatitis C. Liver Int 2016;36:925–928.
- Lau G, Benhamou Y, Chen G, et al. Efficacy and safety of 3-week response-guided triple direct-acting antiviral therapy for chronic hepatitis C infection: a phase 2, open-label, proof-of-concept study. Lancet Gastroenterol Hepatol 2016;1:97–104.
Имеются противопоказания! Необходима консультация специалиста