По оценкам, во всем мире 185 миллионов человек хронически инфицированы ВГС, при этом происходит 3-4 миллиона новых заражений в год и более 350 000 смертей из-за болезни печени, связанных с ВГС (Gower et al., 2014). Среди первично инфицированных, 15-50% происходит спонтанное самоизлечение в течение первых 2-6 месяцев, после чего остаются антитела к ВГС (Freiman et al., 2016). В остальных случаях происходит хронизирование инфекции, характеризующуееся выявлением РНК ВГС и присутствием антител к ВГС (Maasoumy and Wedemeyer, 2012).
Долгосрочное воздействие ВГС сильно варьируется: от минимальных эффектов до хронического гепатита, развитого фиброза, цирроза, декомпенсированного цирроза и гепатоцеллюлярной карциномы (Maasoumy and Wedemeyer, 2012). Хроническая инфекция ВГС также может вызывать серьезные внепеченочные осложнения. Целью терапии является устранение ВГС для предотвращения печеночных и внепеченочных осложнений и улучшения общей выживаемости (Global Burden of Hepatitis, 2004).
Современные достижения в лечении ВГС продемонстрировали существенный рост устойчивого вирусологического ответа (УВО). С помощью препаратов прямого противовирусного действия высокие показатели УВО могут быть достигнуты независимо от генотипа, степени фиброза печени или предшествующей терапии у большинства групп пациентов. (Ward and Mermin, 2015; Linas et al., 2014).
В свете успехов в терапии ВГС для обеспечения широкого доступа к этим новым методам лечения требуется упрощение подтверждения диагноза. Внедрение этих высокоэффективных методов лечения устранило потребность в терапии с оценкой обратной связи и уменьшило роль мониторинга с помощью высокочувствительных количественных тестов РНК ВГС (Chevaliez et al., 2016). Тем не менее, выявление РНК остается необходимым для подтверждения инфекции ВГС и оценки вирусологического ответа, в частности достижения УВО.
Во время сборки вирусных частиц нуклеокапсид высвобождается в плазме и может быть обнаружен ранее, чем антитела, в том числе во время первичного инфицирования (Freiman et al., 2016). Количество основного антигена ВГС в крови коррелирует с уровнем РНК ВГС. Таким образом, основной антиген ВГС помогает идентифицировать пациентов, инфицированных ВГС и является суррогатным маркером репликации ВГС (Morota et al., 2009; Mederacke et al., 2009; Ross et al., 2010; Medici et al., 2011; Heidrich , 2014; Ottiger et al., 2013; Bouvier-Alias et al., 2002; Chevaliez et al., 2014). Обнаружение основного антигена Abbott ARCHITECT HCV (HCV cAg) основано на двухэтапном иммуноанализе (Abbott Diagnostics, Abbott Park, IL, USA) с использованием технологии Chemiluminescent Microparticle Immunoassay (CMIA) для количественного определения основного антигена ВГС. Этот тест является быстрым диагностическим методом, давая результаты примерно в течение часа и менее дорогостоящим, чем методы ПЦР, однако имеет предлагаемый предел обнаружения между 1000 МЕ/мл и 3000 МЕ/мл в зависимости от генотипа ВГС.
Целью данного исследования была оценка HCA cAg с помощью аналитической системы ARCHITECT для выявления активной хронической инфекции ВГС и возможности отличить ее от спонтанного самоизлечения, при наблюдении за пациентами, получающими препараты прямого противовирусного действия, а также выявить пациентов, которые не успешно прошли курс терапии в рандомизированном клиническом исследовании с новыми препаратами.
Исследование AVIATOR (Garbuglia et al., 2014) было открытым исследованием с 14 различными подгруппами пациентов, предназначенным для оценки безопасности и эффективности различных комбинаций ритонавира, паритапревира (ингибитор протеазы NS3-4A) и омбитавира (ингибитор NS5A) с дасабувиром (не нуклеозидный ингибитор РНК-зависимой РНК-полимеразы ВГС), как в сочетании с рибавирином (RBV), так и без него в течение 8, 12 или 24 недель у пациентов с 1 генотипом независимо от наличия или отсутствия цирроза [NCT01464827]. В данном анализе были изучены в общей сложности 1201 образцов плазмы от 411/571 субъектов, которые участвовали в исследовании Aviator, для которых были известны уровни РНК ВГС и весь доступный объем выборки, был ретроспективно проверен слепым способом с помощью анализа HCV cAg. Временные моменты включали базовый уровень (N = 411), 4-неделю (N = 396) и 12-неделю после лечения (N = 394). Результаты HCV cAg анализировали для определения уровней согласования с уровнями РНК ВГС, измеренных с помощью анализатора Roche High-Pure-System / COBAS® TaqMan® v2.0 (HPS, Roche Diagnostics, Indianapolis, IN, USA). Анализ дискордантности между HPS и HCV cAg проводился с использованием чувствительности 25 МЕ/мл, которая использовалась в качестве первичной конечной точки в исследовании AVIATOR.
Последовательный анализ части генома ВГС, кодирующего антиген вируса, проводили с использованием 5 мкл РНК, экстрагированной на Abbott m2000sp и одностадийных RT-PCR-реагентах (QIAGEN, Hilden, GmbH) в соответствии с условиями циклирования, предложенными изготовителем. ПЦР-фрагмент 597 пар оснований амплифицировали с использованием прямого праймера HCV-78Fb (5'GCCTTGTGGTACTGCCTGATA3) и смесь двух обратных праймеров HCV-852Rb (5'GG AAG ATA GAG AAA GAG CAA CC3) и HCV-852Rc (5'AGG AAG ATA GAA AAG GAG CAA CC3 ') была секвенирована непосредственно с использованием ABI Prism Big Dye Terminator v3.1 Набор реакций циклического секвенирования (Applied Biosystems, Austin, TX, USA) и генетический анализатор ABI PRISM 3130 (Applied Biosystems, Austin, TX ). Данные последовательности были собраны и отредактированы с помощью программного обеспечения Sequencher Version 5.4 (Gene Code Corporation, Ann Arbor, MI, USA). Аминокислотную последовательность анализировали на мутации Ag с использованием программного обеспечения Lasergene v11.2.1 (DNASTAR, Madison, WI, USA). Измерения HPS, HCV cAg и АРТ проводились в соответствии с инструкциями производителей.
Кроме того, для оценки специфичности теста HCV cAg было использовано 289 образцов доноров крови из Американского Красного Креста и 37 образцов пациентов из Боннского университета, которые имели не определяемую РНК ВГС. Все пациенты из Боннского участка неоднократно испытывали положительный результат на антитела к ВГС, но определение РНК ВГС в течение по меньшей мере 6 месяцев было отрицательно, что свидетельствовало о спонтанном самоизлечении ВГС. Ни один из пациентов никогда не проходил лечение.
Все данные были проанализированы с помощью программного комплекса SAS 9.3 (SAS Institute Cary, Северная Каролина, США).
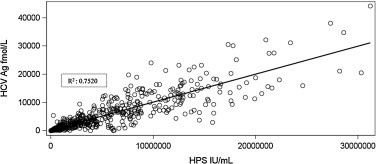
Линейную регрессию наименьших квадратов проводили для изучения связи между результатом анализа HPS (IU / ml) и HCV cAg (fmol / l). Данные были построены и рассчитаны коэффициент корреляции Пирсона, коэффициент определения, точечные оценки наклона и перехвата линии регрессии.
Все пациенты предоставили письменное информированное согласие. Исследование проводилось в соответствии с руководящими принципами надлежащей клинической практики (GCP) и принципами Хельсинкской декларации, а протокол исследования был одобрен соответствующими институциональными советами и регулирующими органами. Это исследование ретроспективно и выполнялось с использованием идентифицированных остаточных образцов, собранных в рамках исследования AVIATOR [NCT01464827].
Наблюдалась положительная корреляция между HCV cAg и HPS (r2 = 0,7520, рис.1). Использование 25 МЕ/мл в качестве нижней границы для определения HPS, АРТ и HCV cAg имело общие согласованные результаты в 1184 из 1201 испытуемых образцов (98,6%), в том числе 409 в образцах предварительной обработки (99,5%), 382 в неделях 4 образца (96,46 %) и 393 в течение 12 недель после лечения (99,75%) (таблица 1). Из 17 несогласных образцов 4 были отрицательными HCV cAg/HPS. Два базовых образца с вирусными нагрузками 3,580,000 и 6,090,000 МЕ / мл с HPS дали отрицательные результаты при определении HCV cAg. Последовательный анализ части генома ВГС, кодирующего антиген вируса, амплифицировали из одного образца (6 090 000 МЕ / мл) и был сравнен с последовательностью моноклональных антител, используемых в тесте HCV cAg, но мы не выявили молекулярной основы для объяснения разницы в результате. Достаточный объем для второго образца секвенирования не был доступен (3580 000 МЕ / мл). Большинство образцов без корреляции (n = 66) относились к 4-х недельным контрольным временным точкам. Только один из положительных образцов отрицательного HPS HCV cAg дал количественную вирусную нагрузку (75 МЕ/мл). Все отрицательные образцы HCV cAg / HPS также были положительными с АРТ (диапазон 1,08 log IU / ml-1,97 log IU / ml - см. Таблицу 2). Все испытуемые с четырьмя несогласованными результатами (n = 66) были обнаружены обоими методами на 12-й неделе терапии. Анализы проб, взятых на 24-й неделе лечения или клинического наблюдения, не были доступны для нескольких пациентов.
Выявление HCV cAg позволило точно идентифицировать активные инфекции у 99,51% пациентов, включенных в это исследование, и четко обозначило отличие достижения УВО от неудачной терапии в 99,75%.
| Visit | Obs. | HPS IU/ml | Abbott RealTime HCV | HCV Ag | Result | ||
| Result | Result | Initial test fmol/l | Retest 1 fmol/l | Retest 2 fmol/l | |||
| Baseline | 1 | 3,850,000 | 5.94 | 1.2 | . | . | Negative |
| 2 | 6,090,000 | No sample | −1.2 | . | . | Negative | |
Таблица 1. Таблица соответствия Roche HPS по отношению к ARCHITECT HCV cAg с использованием чувствительности 25 МЕ/мл в качестве среза.
| Visit | Obs. | HPS IU/ml | Abbott RealTime HCV | HCV Ag | Result | ||
| Result | Result |
Initial test fmol/l |
Retest 1 fmol/l |
Retest 2 fmol/l |
|||
| Baseline | 1 | 3,850,000 | 5.94 | 1.2 | . | . | Negative |
| 2 | 6,090,000 | No sample | −1.2 | . | . | Negative | |
| Week 4 | 3 | <25 IU/ml HCV RNA detected | Detected < 1.48 | −1.1 | . | . | Negative |
| 4 | <25 IU/Ml HCV RNA Detected | Detected < 1.48 | 2 | . | . | Negative | |
| 5 | HCV RNA not detected | 1.28 | 3.3 | 3 | 1.8 | Positive | |
| 6 | <25 IU/ml HCV RNA Detected | <1.08 | 0.3 | . | . | Negative | |
| 7 | <25 IU/ml HCV RNA Detected | Detected < 1.48 | 0.7 | . | . | Negative | |
| 8 | <25 IU/ml HCV RNA Detected | <1.08 | −0.1 | . | . | Negative | |
| 9 | <25 IU/ml HCV RNA detected | <1.08 | 0.4 | . | . | Negative | |
| 10 | <25 IU/ML HCV RNA Detected | Detected < 1.08 | 0.5 | . | . | Negative | |
| 11 | <25 IU/ml HCV RNA detected | 1.43 | 2.4 | . | . | Negative | |
| 12 | <25 IU/ml HCV RNA detected | <1.08 | 0.7 | . | . | Negative | |
| 13 | <25 IU/ML HCV RNA DETECTED | 1.15 | 0.1 | . | . | Negative | |
| 14 | <25 IU/ml HCV RNA Detected | Qns | 1.5 | . | . | Negative | |
| 15 | <25 IU/ml HCV RNA detected | 1.59 | 2.5 | . | . | Negative | |
| 16 | <25 IU/ml HCV RNA detected | 1.52 | 1.2 | . | . | Negative | |
| 17 | HCV RNA not detected | Detected < 1.08 | 3.4 | 4.4 | 3.4 | Positive | |
| 18 | <25 IU/ml HCV RNA detected | 1.27 | 0 | . | . | Negative | |
| 19 | <25 IU/ml HCV RNA detected | 1.76 | 0.4 | . | . | Negative | |
| 20 | <25 IU/ml HCV RNA detected | 1.46 | 1.4 | . | . | Negative | |
| 21 | 75 | 1.82 | 2.2 | . | . | Negative | |
| 22 | <25 IU/ml HCV RNA detected | Detected < 1.48 | 4.1 | 2.8 | 2.8 | Negative | |
| 23 | HCV RNA not detected | Detected < 1.48 | 13 | . | . | Positive | |
| 24 | <25 IU/ml HCV RNA detected | 1.91 | 2.2 | . | . | Negative | |
| 25 | <25 IU/ml HCV RNA detected | 1.19 | 0.7 | . | . | Negative | |
| 26 | <25 IU/ml HCV RNA detected | 1.7 | 2.4 | . | . | Negative | |
| 27 | <25 IU/ml HCV RNA detected | 1.34 | 3.1 | 1.2 | 1.1 | Negative | |
| 28 | <25 IU/ml HCV RNA detected | 1.93 | 2.1 | . | . | Negative | |
| 29 | HCV RNA not detected | <1.08 | 4.7 | 3.8 | 5.5 | Positive | |
| 30 | <25 IU/ml HCV RNA detected | Detected < 1.08 | 0.4 | . | . | Negative | |
| 31 | <25 IU/ml HCV RNA detected | Detected < 1.08 | 0.4 | . | . | Negative | |
| 32 | <25 IU/ml HCV RNA detected | 1.18 | 1.4 | . | . | Negative | |
| 33 | HCV RNA not detected | 1.97 | 4.5 | 4 | 1.9 | Positive | |
| 34 | HCV RNA not detected | 1.73 | 5.4 | 5.6 | 3.9 | Positive | |
| 35 | <25 IU/ml HCV RNA detected | <1.08 | 2.1 | . | . | Negative | |
| 36 | HCV RNA not detected | 1.71 | 4.3 | 3.4 | 2.7 | Positive | |
| 37 | HCV RNA not detected | Detected < 1.48 | 3.8 | 3.8 | . | Positive | |
| 38 | <25 IU/ml HCV RNA detected | Detected < 1.08 | 0.8 | . | . | Negative | |
| 39 | <25 IU/ml HCV RNA detected | 1.4 | 1.8 | . | . | Negative | |
| 40 | <25 IU/ml HCV RNA detected | Detected < 1.48 | 0.1 | . | . | Negative | |
| 41 | <25 IU/ml HCV RNA detected | 1.24 | 1 | . | . | Negative | |
| 42 | <25 IU/ml HCV RNA detected | 1.55 | 1.3 | . | . | Negative | |
| 43 | HCV RNA not detected | Detected < 1.48 | 8.4 | 9.7 | 10.7 | Positive | |
| 44 | <25 IU/ML HCV RNA detected | Detected < 1.48 | 1.8 | 0.9 | . | Negative | |
| 45 | <25 IU/ml HCV RNA detected | Detected < 1.48 | 1.9 | . | . | Negative | |
| 46 | <25 IU/ml HCV RNA detected | 1.88 | 1.9 | . | . | Negative | |
| 47 | HCV RNA not detected | 1.91 | 4.6 | 4.1 | 3.7 | Positive | |
| 48 | <25 IU/ml HCV RNA detected | 1.44 | 0.2 | . | . | Negative | |
| 49 | <25 IU/ML HCV RNA detected | 1.88 | 2.4 | . | . | Negative | |
| 50 | <25 IU/ML HCV RNA detected | Detected < 1.48 | 0.8 | . | . | Negative | |
| 51 | <25 IU/ml HCV RNA detected | Detected < 1.48 | 0.6 | . | . | Negative | |
| 52 | <25 IU/ml HCV RNA detected | Detected < 1.48 | 0.9 | . | . | Negative | |
| 53 | <25 IU/ml HCV RNA detected | Detected < 1.08 | 1.3 | . | . | Negative | |
| 54 | <25 IU/ml HCV RNA detected | 2.21 | 1.9 | . | . | Negative | |
| 55 | <25 IU/ml HCV RNA detected | 1.68 | 0.3 | . | . | Negative | |
| 56 | <25 IU/ml HCV RNA detected | Detected < 1.48 | 4.9 | 1.1 | 0.9 | Negative | |
| 57 | <25 IU/ml HCV RNA detected | Detected < 1.48 | 0.6 | . | . | Negative | |
| 58 | <25 IU/ml HCV RNA detected | Target not detected | 1.5 | . | . | Negative | |
| 59 | HCV RNA not detected | Detected < 1.48 | 4.3 | 5.6 | . | Positive | |
| 60 | <25 IU/ml HCV RNA detected | Detected < 1.48 | 1.9 | . | . | Negative | |
| 61 | <25 IU/ml HCV RNA detected | 1.86 | 2.8 | . | . | Negative | |
| 62 | <25 IU/ml HCV RNA detected | 2.13 | 2.1 | . | . | Negative | |
| 63 | <25 IU/ml HCV RNA detected | 1.57 | 2.3 | . | . | Negative | |
| 64 | <25 IU/ml HCV RNA detected | Detected < 1.48 | 1 | . | . | Negative | |
| 65 | <25 IU/ml HCV RNA detected | Target not detected | −0.1 | . | . | Negative | |
| 66 | HCV RNA not detected | Detected < 1.48 | 4.3 | 4.2 | 5.1 | Positive | |
| 67 | HCV RNA not detected | Detected < 1.48 | 3.2 | 3 | 2.6 | Positive | |
| 68 | <25 IU/ml HCV RNA detected | Detected < 1.48 | 0.9 | . | . | Negative | |
| PTW 12 | 69 | <25 IU/ml HCV RNA detected | Target not detected | 0.3 | . | . | Negative |
| 70 | 2180 | 3.01 | 3.2 | 2.5 | 2.3 | Negative | |
| 71 | <25 IU/ML HCV RNA detected | Detected < 1.48 | 0.3 | 0 | . | Negative | |
Таблица 2. Дискордантная таблица Roche HPS по отношению к ARCHITECT HCV cAg с анализом HCV Abbott RealTime в качестве референтного метода. Det = обнаружено; ND = не обнаружено; PTW 12 = 12 неделя после терапии.
Все 326 положительных случая anti-HCV с отрицательной РНК ВГС, исследованных с учетом HCA cAg, дали отрицательные результаты, демонстрируя 100%-ное соответствие с данными ПЦР и показали 100% специфичность теста для данной группы пациентов.
В этом исследовании Abbott ARCHITECT HCV cAg точно идентифицировал пациентов с активной виремией при скрининге с точностью 99,51% (409/411), подтверждая, что обнаружение основного антигена ВГС может позволить точно диагностировать активную инфекцию в образцах с вирусной нагрузкой >50000МЕ/мл. Кроме того, подавляющее большинство несогласных результатов между HCV cAg и HPS были получены из образцов взятых на 4-ой неделе при очень низком уровне виремии, что не имело бы клинического значения.
Методика определения cAg HCV выявляла достижение УВО спустя 12 недель с момента завершения терапии в 99,75% (393/394) испытуемых испытуемых. У данного пациента не удалось проверить HCV cAg, и хотя он был идентифицирован как не достигший УВО с помощью выявления РНК ВГС, другие исследования показали, что некоторые пациенты имеют рецидив после достижения УВО12, подтвержденным самым чувствительным методом (Yoshida et al., 2015). Несмотря на то, что для 100%-ного точного определения УВО может потребоваться дополнительный анализ после достижения УВО12, целесообразность использование дорогостоящего метода ПЦР для оценки достижения УВО24 является спорным. Наши результаты свидетельствуют о том, что определение HCV cAg может быть использовано подтверждения достижения УВО12 с большой точностью практически у всех пациентов.
Это исследование показывает, что тестирование HCV cAg вместо контроля РНК ВГС можно безопасно использовать во время лечения пациентов с ВГС-инфекцией, получающих терапию на основе ПППД (Chevaliez et al., 2016; Kowdley et al., 2014; Adhemo et al. , 2016). Хотя результаты нашего исследования сосредоточены на первом генотипе ВГС, они согласуются с результатами других, которые изучали способность ARCHITECT HCV Ag обнаружить HCV cAg в образцах с обнаруживаемой РНК ВГС. Данные по 4534 образцам из 19 исследований с ограничением 3 fmol/l cAg с интервалом повторения 3-10 фмоль/л продемонстрировали общую чувствительность анализа cAg относительно обнаружения ВГС 92,9%. (Chevaliez et al., 2016; Morota et al., 2009; Mederacke et al., 2009; Ross et al., 2010; Medici et al., 2011; Heidrich, 2014; Ottiger et al., 2013; Bouvier-Alias et al., 2002; Chevaliez et al., 2014; Garbuglia et al., 2014; Kowdley et al., 2014; Adhemo et al., 2016; Medici et al., 2016; Kesli et al., 2011; Mederacke et al., 2012; Ergünay et al., 2011; Buket et al., 2014; Vermehren et al., 2012; Hadziyannis et al., 2013; Kadkhoda and Smart, 2014; Park et al., 2010; Tedder et al. , 2013; Freiman et al., 2016).
Следует отметить, что в образцах с вирусной нагрузкой > 10000 МЕ/мл чувствительность повышалась до 99,5%, что хорошо коррелирует с нашими результатами исследования AVIATOR, у которого был критерий включения, требующий, чтобы субъекты имели вирусную нагрузку не менее 50000 МЕ/мл.
Несмотря на то, что два образца с вирусными нагрузками 3,580,000 и 6,090,000 МЕ / мл при тестировании с HPS показывали отрицательный HCV cAg, это, по-видимому, очень редкое явление, в свою очередь, в образце, который имел достаточный объем для проведения анализа, отсутствие какой-либо мутации в последовательности вирусной РНК может указывать на механизм молекулярного характера, который потенциально обусловил отрицательный результат HCA cAg. Однако, мы не исключаем, что эта ошибка может быть результатом человеческого фактора или ошибки обработки данных.
В некоторых исследованиях, изучающих HCV cAg, также указывались ограничения для проведения анализа. По сравнению с анализом РНК ВГС было очевидно, что некоторые образцы с крайне низкой вирусной нагрузкой не были обнаружены с помощью анализа HCV cAg, что и ожидалось, учитывая его аналитическую чувствительность. Таким образом, чтобы достичь 100%-ной уверенности в наличии активной виремии в образце с отрицательным результатом определения HCA HCV, можно произвести подтверждение с помощью ПЦР анализа. Поскольку ожидается, что количество отрицательных результатов HCV cAg будет очень низким, количество проведенных ПЦР исследований, необходимых для подтверждения отрицательных результатов HCA cAg, может быть существенно уменьшено при сохранении задачи 100% обнаружения виремии (Freiman et al., 2016). В нашем исследовании все 326 образца с обнаруженными антителами к ВГС не выявили HCV cAg, а специфичность диагностической методики определения cAg HCV статистически была рассчитана как 100%.
Результаты этого и других исследований показывают, что диагностическая методика выявления HCV cAg может быть использована для точной идентификации пациентов с хронической ВГС-инфекцией и для контроля достижения УВО. Важно отметить, что специфичность HCA cAg в очень сложной группе пациентов (antiHCV-positive, RNA HCV negative), описанная в исследовании, дает уверенность в том, что использование этой методики не приведет к ложным результатам идентификации пациентов и всеми связанными с этим клиническими, психологическими и финансовыми последствиями.
Использование методики определения HCV Ag при диагностике и мониторинге лечения должно обеспечить улучшение качества проведения противовирусной терапии и ее контроля, что особенно важно для регионов, в которых определение РНК ВГС дорогостоящее или труднодоступно.
Источник:
«HCV core antigen as an alternate test to HCV RNA for assessment of virologic responses to all-oral, interferon-free treatment in HCV genotype 1 infected patients»
Journal of Virological Methods. Volume 245, July 2017 , Pages 14-18
https://doi.org/10.1016/j.jviromet.2017.03.002
Коллектив авторов:
Jürgen KurtRockstroh a, Jordan J.Feld b, Stéphane Chevaliez c, Kevin Cheng d, Heiner Wedemeyer e, Christoph Sarrazin f, Benjamin Maasoumy f, Christine Herman d, John Hackett Jr. d, Daniel E. Cohen g, George J.Dawson d, Gavin Cloherty d, Jean-Michel Pawlotsky c
a — University Hospital Bonn, Bonn, Germany
b — Toronto Centre for Liver Disease McLaughlin-Rotman Centre for Global Health University of Toronto, Toronto, ON, Canada
c — National Reference Center for Viral Hepatitis B C and D Department of Virology Hôpital Henri Mondor Université Paris-Est and INSERM U955, Créteil, France
d — Abbott Laboratories, Abbott Park, IL, USA
e — Klinik für Gastroenterologie Hepatologie und Endokrinologie Medizinische Hochschule Hannover, Hannover, Germany
f — Medizinische Klinik 1 Universitätsklinikum Frankfurt, Frankfurt am Main, Germany
g — Abbvie, North Chicago, IL, USA
Похожие статьи:
- HCV Advisor - консультант по гепатиту C
Появилось приложение для больных хроническим вирусным гепатитом С, разработанное под смартфоны Android и IOS. Приложение…
- Положительный анализ на гепатит С антител Anti-HCV-total
При заражении гепатитом С в кровь пациента начинают выделяться иммуноглобулины различных типов. Это говорит об…
- Новый подтип HCV-6 в Северной Америке
Высокое генетическое разнообразие и обнаружение нового подтипа HCV-6 среди иммигрантов азиатского происхождения в Северной Америке…
Имеются противопоказания! Необходима консультация специалиста